
| A. | KNO3 | B. | NH4Cl | C. | NaHCO3 | D. | NaHSO4 |
科目:高中化学 来源: 题型:多选题
| A. | 检验亚硫酸钠试样是否变质:试样$\stackrel{溶解}{→}$ $\stackrel{硝酸钡溶液}{→}$白色沉淀$\stackrel{稀硝酸}{→}$沉淀不溶 | |
| B. | 检验某卤代烃是否是氯代烃:试样$→_{煮沸}^{氢氧化钠溶液}$ 冷却 $\stackrel{稀硫酸至酸性}{→}$ $\stackrel{硝酸银溶液}{→}$出现白色沉淀 | |
| C. | 证明酸性条件H2O2氧化性比I2强:NaI溶液$\stackrel{30%H_{2}O_{2}溶液}{→}$ $\stackrel{稀硝酸及淀粉}{→}$溶液变蓝色 | |
| D. | 除去氯化钠晶体中少量硝酸钾:试样$\stackrel{加适量水溶解}{→}$ $\stackrel{蒸发到剩少量液体}{→}$ $\stackrel{趁热过滤}{→}$ $\stackrel{洗涤晶体}{→}$再重结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰中存在极性键、非极性键、范德华力、氢键 | |
| B. | MCO3型碳酸盐,其分解温度越高,则分解后生成的金属氧化物的晶格能越大 | |
| C. | 等质量的金刚石晶体和石墨晶体含有的碳碳σ键数目相同 | |
| D. | 干冰的晶胞中CO2分子数目和金属铜的晶胞中Cu原子数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾净水 | |
| B. | 使用热的纯碱溶液去除油污 | |
| C. | 实验室配制FeCl3溶液时加入少量稀盐酸 | |
| D. | 实验室制氢气时加入CuSO4可加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
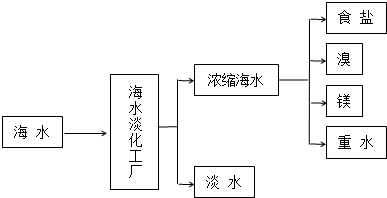

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯塑料制品可用于食品的包装 | |
| B. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量 | |
| C. | 原电池放电发生化学变化,同时能量发生转化 | |
| D. | 开发太阳能,推广使用甲醇汽油,使用无磷洗涤剂都可直接降低碳排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、CO32-、S2-、Cl- | B. | NO3-、Br-、Na+、NH4+ | ||
| C. | Na+、K+、Cl-、HS- | D. | Na+、NO3-、Fe3+、SO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
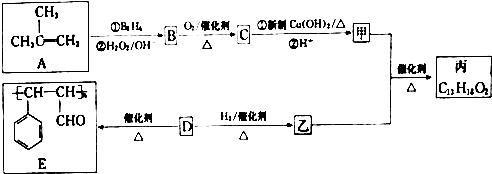
 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$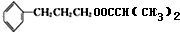 +H2O.
+H2O. .
.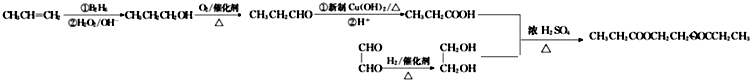 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 往含0.2mol NaOH和0.1mol Ca(OH)2的混合溶液中持续稳定地通入CO2气体0.5mol.请以CO2的量为横坐标,以溶液中离子的总量为横坐标,画出离子总量随CO2加入量变化的折线图.(不计弱电解质的电离和盐的水解)
往含0.2mol NaOH和0.1mol Ca(OH)2的混合溶液中持续稳定地通入CO2气体0.5mol.请以CO2的量为横坐标,以溶液中离子的总量为横坐标,画出离子总量随CO2加入量变化的折线图.(不计弱电解质的电离和盐的水解)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com