
| A. | 通入CO2 | B. | 通入NH3 | C. | 冷却母液 | D. | 加入食盐 |
分析 饱和NH4Cl溶液中存在溶解平衡:NH4Cl(s)?NH4+(aq)+Cl-(aq),若要析出氯化铵,应该使平衡向着逆向移动,如:增大铵根离子、氯离子浓度,或者降低温度,据此进行解答.
解答 解:母液中析出NH4Cl,则溶液应该达到饱和,饱和NH4Cl溶液中存在溶解平衡:NH4Cl(s)?NH4+(aq)+Cl-(aq),若要析出氯化铵,应该使平衡向着逆向移动,
A.通入二氧化碳后,对铵根离子和氯离子没有影响,则对母液中析出NH4Cl无帮助,故A正确;
B.通入氨气后,溶液中铵根离子浓度增大,平衡向着逆向移动,有利于氯化铵的析出,故B错误;
C.冷却母液,氯化铵的溶解度降低,有利于氯化铵的析出,故C错误;
D.加入食盐,溶液中氯离子浓度增大,平衡向着逆向移动,有利于氯化铵的析出,故D错误;
故选A.
点评 本题考查了溶解平衡及其应用,题目难度不大,明确影响溶解平衡的因素为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:推断题
 .
. +nOHCH2CH2OH$\stackrel{一定条件}{→}$
+nOHCH2CH2OH$\stackrel{一定条件}{→}$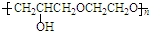 +nHCl
+nHCl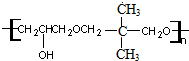 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
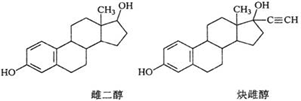
| A. | 能与Na、NaOH溶液、Na2CO3溶液反应 | |
| B. | 能发生加成反应、取代反应、消去反应 | |
| C. | 该分子中所有碳原子不可能在同一个平面内 | |
| D. | 可与FeCl3溶液发生显色反应,但不能与O2发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 根据上表,向足量NaClO溶液中通入CO2:CO2+H2O+2ClOˉ═2HClO+CO32- | |
| B. | 向上述 NaClO溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>c(HClO) | |
| C. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF | |
| D. | 若将CO2通入0.1mol•L-1Na2CO3溶液中至溶液中性,则溶液中2c(CO32-)+c (HCO3-)=0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠可用于制备木材防火剂 | B. | 硅单质广泛用于光纤通讯 | ||
| C. | 硅酸可由二氧化硅与水反应制得 | D. | 水晶项链是硅酸盐制品 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
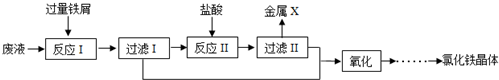
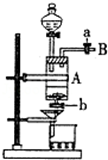 三氯化铁是中学化学实验室中常用的化学试剂.同学们利用废铁屑(含少量铜杂质)来探究制备FeCl3•6H2O的方法,同学甲设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有足量的稀硝酸,实验时先打开a并关闭b,用分液漏斗向A中加入过量的盐酸充分反应,此时溶液呈浅绿色;再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3•6H2O晶体.
三氯化铁是中学化学实验室中常用的化学试剂.同学们利用废铁屑(含少量铜杂质)来探究制备FeCl3•6H2O的方法,同学甲设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有足量的稀硝酸,实验时先打开a并关闭b,用分液漏斗向A中加入过量的盐酸充分反应,此时溶液呈浅绿色;再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3•6H2O晶体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com