
如图表示常见元素单质及化合物相应关系,某些生成物已略去。

已知:反应①为氯碱工业的基础反应;X、Y为常见金属,Z为形成酸雨的主要成分。请回答下列问题:
(1)D的电子式 ;H为 (填化学式)。
(2)完成下列方程式:
①空气中含量最高的气体与C反应的化学反应方程式 ;
②反应②的化学反应方程式 ;
③足量B通入H溶液的离子反应方程式 。
(1)Na+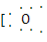 H]- NaHSO3
H]- NaHSO3
(2)①N2+3H2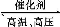 2NH3
2NH3
②2Al+Fe2O3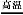 2Fe+Al2O3(或2Al+3CuO
2Fe+Al2O3(或2Al+3CuO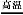 3Cu+Al2O3)
3Cu+Al2O3)
③Cl2+HSO3-+H2O=2Cl-+SO42-+3H+
【解析】氯碱工业基础反应为电解饱和食盐水的反应,反应方程式为2NaCl+2H2O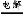 2NaOH+H2↑+Cl2↑,故D为NaOH;又因为B能与金属X反应,故B、C分别为Cl2、H2;联想Cl2能与Fe、Cu、Na等反应,若X为Fe(Cu),则E为FeCl3(CuCl2),F为Fe2O3(CuO);反应②为金属与金属氧化物在高温下发生的反应,应该是铝热反应,可推测Y为Al,则G为Al2O3,则I为NaAlO2。形成酸雨的主要气体为SO2和NOx,过量二氧化硫气体通入氢氧化钠溶液生成NaHSO3,NaAlO2溶液中通过量SO2气体也生成NaHSO3。若Z为NO2,NO2通入NaOH溶液生成NaNO3、NaNO2和H2O,题中H溶液中溶质只有一种,所以Z只能为SO2,H为NaHSO3。空气中含量最高的气体为N2,N2与H2反应方程式为N2+3H2
2NaOH+H2↑+Cl2↑,故D为NaOH;又因为B能与金属X反应,故B、C分别为Cl2、H2;联想Cl2能与Fe、Cu、Na等反应,若X为Fe(Cu),则E为FeCl3(CuCl2),F为Fe2O3(CuO);反应②为金属与金属氧化物在高温下发生的反应,应该是铝热反应,可推测Y为Al,则G为Al2O3,则I为NaAlO2。形成酸雨的主要气体为SO2和NOx,过量二氧化硫气体通入氢氧化钠溶液生成NaHSO3,NaAlO2溶液中通过量SO2气体也生成NaHSO3。若Z为NO2,NO2通入NaOH溶液生成NaNO3、NaNO2和H2O,题中H溶液中溶质只有一种,所以Z只能为SO2,H为NaHSO3。空气中含量最高的气体为N2,N2与H2反应方程式为N2+3H2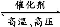 2NH3。反应②化学方程式为:2Al+Fe2O3
2NH3。反应②化学方程式为:2Al+Fe2O3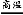 2Fe+Al2O3或2Al+3CuO
2Fe+Al2O3或2Al+3CuO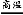 3Cu+Al2O3。Cl2具有氧化性,HS
3Cu+Al2O3。Cl2具有氧化性,HS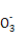 具有还原性,足量Cl2通入NaHSO3溶液中发生氧化还原反应,离子方程式为Cl2+HSO3-+H2O=2Cl-+SO42- +3H+。
具有还原性,足量Cl2通入NaHSO3溶液中发生氧化还原反应,离子方程式为Cl2+HSO3-+H2O=2Cl-+SO42- +3H+。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014高考化学专题突破训练 专题3氧化还原反应 离子反应练习卷(解析版) 题型:选择题
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列关于离子共存说法中正确的是( )
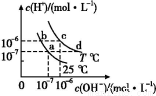
A.a点对应的溶液中大量存在:Fe3+、Na+、Cl-、S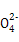
B.b点对应的溶液中大量存在:N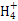 、Ba2+、OH-、I-
、Ba2+、OH-、I-
C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、HC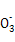
D.d点对应的溶液中大量存在:Na+、K+、S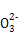 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题13物质结构与性质选修3练习卷(解析版) 题型:填空题
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态Ni原子的价电子(外围电子)排布式为 ;
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式 、 ;
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
如①CH2=CH2、②HC≡CH、③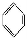 、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形;
、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形;
(4)Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiO FeO(填“<”或“>”);
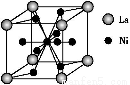
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如下图所示。该合金的化学式为 ;
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题11常见有机物及其应用练习卷(解析版) 题型:选择题
分子式为C3H2Cl6的同分异构体共有(不考虑立体异构)( )
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题11常见有机物及其应用练习卷(解析版) 题型:选择题
既可以用来鉴别乙烷和乙烯,又可以用来除去乙烷中混有的少量乙烯的操作方法是( )
A.混合气体通过盛水的洗气瓶
B.混合气体通过装有过量溴水的洗气瓶
C.混合气体和过量H2混合
D.混合气体通过酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题10非金属及其化合物练习卷(解析版) 题型:选择题
如图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O。对实验现象的“解释或结论”正确的是( )
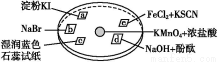
选项实验现象解释或结论
Aa处变蓝,b处变红棕色氧化性:Cl2>Br2>I2
Bc处先变红,后褪色氯气与水生成了酸性物质
Cd处立即褪色氯气与水生成了漂白性物质
De处变红色还原性:Fe2+>Cl-
查看答案和解析>>
科目:高中化学 来源:2014江苏省扬州市届高三上学期期末考试化学试卷(解析版) 题型:填空题
以粗氧化锌粉(含FeO、Fe2O3、ZnS等)制取活性ZnO的工艺如下:
步骤1:以H2SO4浸出粗氧化锌,同时加入H2O2;
步骤2:过滤,调节滤液的pH;
步骤3:过滤,向滤液中加NH4HCO3,得碱式碳酸锌沉淀;
步骤4:过滤、洗涤、煅烧,得产品。
已知:离子沉淀的pH见下表。
离子 | 开始沉淀pH | 沉淀完全pH |
Fe2+ | 7.6 | 9.6 |
Fe3+ | 2.7 | 3.7 |
Zn2+ | 5.4 | 8.0 |
(1)加入H2O2时能浸出硫化锌,同时生成淡黄色固体,写出其化学方程式 。
(2)步骤2中调节溶液pH的范围是 。
(3)取洗涤、干燥后的碱式碳酸锌68.2 g,充分灼烧后测得残留物质的质量为48.6 g,将所得气体通入足量澄清石灰水中,得沉淀20 g。计算碱式碳酸锌的组成(用化学式表示,写出计算过程)。
查看答案和解析>>
科目:高中化学 来源:2014江苏省扬州市届高三上学期期末考试化学试卷(解析版) 题型:选择题
化学与技术、社会和环境密切相关。下列说错误的是
A.煤炭经气化、液化和干馏等过程,可以转化为清洁能源
B.利用二氧化碳制造全降解塑料,可以缓解温室效应
C.充分开发利用天然纤维,停止使用各种化学合成材料
D.加大秸秆的综合利用,如发酵制沼气、生产乙醇等,提高资源的利用率
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 9-3 人工合成有机化合物练习卷(解析版) 题型:选择题
科学家新合成一种高分子化合物,其结构简式为 ,据生物学家验证,它对人类牙齿有较好的保健作用。关于合成此高聚物,有关说法正确的是(已知:nCH2=CH—CH=CH2
,据生物学家验证,它对人类牙齿有较好的保健作用。关于合成此高聚物,有关说法正确的是(已知:nCH2=CH—CH=CH2 ?CH2—CH=CH—CH2?)( )
?CH2—CH=CH—CH2?)( )
A.加聚反应 二种单体 B.缩聚反应 二种单体
C.加聚反应 三种单体 D.缩聚反应 三种单体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com