
| A. | 反应放出197 kJ 的热量 | |
| B. | 生成SO3为2 mol | |
| C. | SO2和SO3物质的量之和为2 mol | |
| D. | SO2的物质的量和SO3物质的量一定相等 |
分析 A.热化学方程式中为完全转化时的能量变化,而将2mol SO2 和1mol O2充入一定容密闭容器中,不能完全转化;
B.可逆反应中生成物不能完全转化为生成物;
C.由S原子守恒可知,反应前后含S的物质的量之和为2mol;
D.SO2的物质的量和SO3物质的量关系与转化率有关.
解答 解:A.热化学方程式中为完全转化时的能量变化,而将2mol SO2 和1mol O2充入一定容密闭容器中,不能完全转化,则放出的热量一定小于197kJ,故A错误;
B.可逆反应中生成物不能完全转化为生成物,则生成SO3一定小于2 mol,故B错误;
C.由S原子守恒可知,反应前后含S的物质的量之和为2mol,则SO2和SO3物质的量之和为2 mol,故C正确;
D.SO2的物质的量和SO3物质的量关系与转化率有关,则二者的物质的量不一定相等,故D错误;
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握热化学方程式的意义、化学平衡的可逆性为解答的关键,侧重分析与应用能力的考查,注意原子守恒及转化率决定物质的量关系,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(H2)=0.03 mol/(L•min) | B. | v(N2)=0.02 mol/(L•min) | ||
| C. | v(NH3)=0.17 mol/(L•min) | D. | v(NH3)=0.01 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③①②④ | B. | ④③②① | C. | ①②③④ | D. | ④①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基的电子式: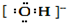 | B. | CH4分子的球棍模型: | ||
| C. | 乙烯的最简式:CH2 | D. | 氟离子的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
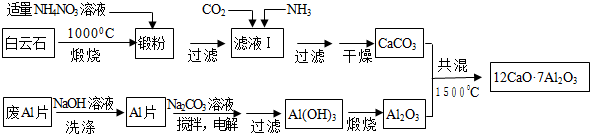
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | H-Cl | H-Br | CI-CI | Br-Br |
| 键能( KJ•mol-1) | 436 | 431 | 299 | 247 | 193 |
| A. | HCl | B. | HBr | C. | H2 | D. | Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| l键能/kJ•mol | 460 | 360 | 436 | 431 | 176 | 347 |
| A. | +412 kJ•mol-1 | B. | -412 kJ•mol-1 | C. | +236 kJ•mol-1 | D. | -236 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
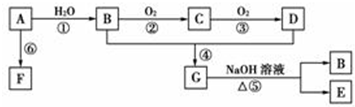
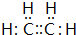 ;C的分子式:C2H4O;D中的官能团:羧基.
;C的分子式:C2H4O;D中的官能团:羧基.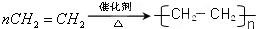 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com