
| A. | 用滴管滴加液体时,滴管应垂悬在容器上方,不能触及容器内壁 | |
| B. | 用药匙或者纸槽把粉末状药品送入试管的底部 | |
| C. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 | |
| D. | 过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 |
分析 A.向试管中滴加溶液时应将胶头滴管垂悬在试管上方;
B.固体药品的取用可以用药匙、镊子或纸槽,将固体放入试管时要防止试管被砸破;
C.量筒不能用于配置溶液;
D.如果放在一层滤纸上,容易损坏滤纸.
解答 解:A.向试管中滴加溶液时应将胶头滴管垂悬在试管上方,不能伸入试管内,故A正确;
B.固体药品的取用可以用药匙、镊子或纸槽,可以用药匙或者纸槽把粉末状药品送入试管的底部,故B正确;
C.量筒不能用于配置溶液,应改为烧杯中进行,故C错误;
D.过滤时玻璃棒的末端应轻轻靠在三层的滤纸上,如果放在一层滤纸上,容易损坏滤纸,故D正确.
故选C.
点评 本题考查较为综合,涉及基础实验操作,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的方法、步骤和使用的仪器,注重相关基础知识的积累,难度不大.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.
苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.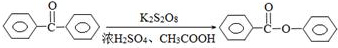
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以用铜丝或铁丝代替铂丝 | |
| B. | 用固体样品或配成的溶液进行实验,现象相同 | |
| C. | 每次实验前,铂丝要先用硫酸洗涤 | |
| D. | 焰色反应实验所用火焰,无论何种燃料均可 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com