
| A. | 氧化铜与稀硫酸反应:O2-+2H+═H2O | |
| B. | Na投入水中:Na+H2O═Na++OH-+H2↑ | |
| C. | 铜与浓硝酸的反应:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 氢氧化钡与稀硫酸的反应:H++2SO42-+2Ba2++OH-═2BaSO4↓+H2O |
分析 A.氧化物应保留化学式;
B.原子个数不守恒;
C.二者反应生成硝酸铜和二氧化氮、水;
D.离子个数配比不符合物质结构.
解答 解:A.氧化铜与稀硫酸反应,离子方程式:CuO+2H+═H2O+Cu2+,故A错误;
B.Na投入水中,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.铜与浓硝酸的反应,离子方程式:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O,故C正确;
D.氢氧化钡与稀硫酸的反应,离子方程式:2H++2SO42-+2Ba2++2OH-═2BaSO4↓+2H2O,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子反应遵循客观事实、遵循原子个数守恒规律,题目难度不大.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
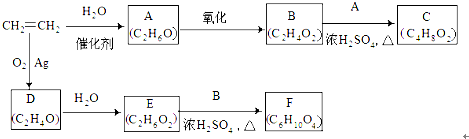
 E
E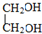 F
F 写出C酸性条件下水解的方程式CH3COOCH2CH3+H2O$?_{△}^{稀H_{2}SO_{4}}$CH3COOH+CH3CH2OH
写出C酸性条件下水解的方程式CH3COOCH2CH3+H2O$?_{△}^{稀H_{2}SO_{4}}$CH3COOH+CH3CH2OH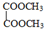 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W的简单气态氰化物比Y的稳定 | |
| B. | XZ2与QY2中含有j的化学键类型相同 | |
| C. | 元素Q、Y的单质均只存在两种同素异形体 | |
| D. | Y的最高价氧化物对应水化物的酸性比Z的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Mg2+、SO42-、Cl- | B. | NH4+、Na+、Cl-、OH- | ||
| C. | K+、Na+、SO42-、NO3- | D. | H+、Cl-、HCO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22g由N2O于CO2组成的混合气体中含有的原子数目为1.5NA | |
| B. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA | |
| C. | 0.1mol•L-1的AlCl3溶液中含有的Cl-数目为0.3NA | |
| D. | 标准状况下,11.2L水中含有的分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
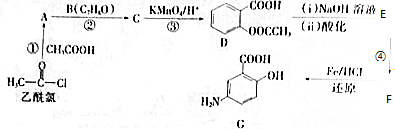

 .
. .
. (写出其中一种结构简式)
(写出其中一种结构简式)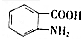 的流程图(无机试剂任选).合成路线流程图如下:
的流程图(无机试剂任选).合成路线流程图如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 磷单质及其化合物在工业生产中有着广泛的应用.白磷可用于制备高纯度的磷酸(
磷单质及其化合物在工业生产中有着广泛的应用.白磷可用于制备高纯度的磷酸(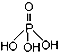 ),三聚磷酸钠(NaH2PO2)可用于化学镀镍等等.请回答下列问题:
),三聚磷酸钠(NaH2PO2)可用于化学镀镍等等.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
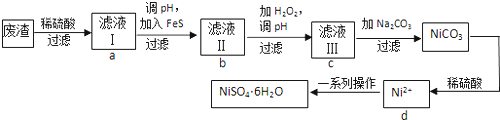
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com