
| A. | 与Al反应能放出H2的溶液中可能大量存在Fe2+、Na+、NO3-、Cl- | |
| B. | 使紫色石蕊变蓝的溶液中可能大量存在Al3+、SO42-、NH4+、CO32- | |
| C. | Al2(SO4)3溶液与氨水的反应:Al3++3OH-=Al(OH)3↓ | |
| D. | FeCl3溶液腐蚀印刷电路板的反应:2Fe3++Cu=2Fe2++Cu2+ |
分析 A.与Al反应能放出H2的溶液中存在大量氢离子或氢氧根离子,亚铁离子与企业广告离子反应,硝酸根离子在酸性条件下能够氧化亚铁离子;
B.使紫色石蕊变蓝的溶液中存在大量氢离子,铝离子、氢离子都与碳酸根离子反应;
C.氨水为弱碱,一水合氨不能拆开;
D.氯化铁与铜反应生成氯化亚铁和氯化铜.
解答 解:A.与Al反应能放出H2的溶液呈酸性或强碱性,Fe2+、NO3-在酸性条件下发生氧化还原反应,Fe2+与氢氧根离子反应,在溶液中一定不能大量共存,故A错误;
B.使紫色石蕊变蓝的溶液呈酸性,溶液中存在大量氢离子,Al3+、H+与CO32-发生反应,在原子不能大量共存,故B错误;
C.硫酸铝与氨水反应生成氢氧化铝沉淀和硫酸铵,一水合氨按不能拆开,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故C错误;
D.FeCl3溶液腐蚀印刷电路板的反应生成氯化亚铁和氯化铜,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故D正确;
故选D.
点评 本题考查离子共存的正误判断、离子方程式书写方法,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况,熟练掌握离子方程式的书写原则,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
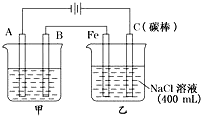 如图为相互串联的甲乙两电解池,试回答:
如图为相互串联的甲乙两电解池,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | 温度差平均值℃ | ||
| H2SO4 | NaOH | 平均值 | ||||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 | 4.0 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | 6.1 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | 3.9 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | 4.1 | |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol CO2 的质量为44g/mol | |
| B. | NA个CO2的质量与CO2的相对分子质量数值上相同 | |
| C. | CO2的摩尔质量等于CO2的相对分子质量 | |
| D. | CO2的摩尔质量为44g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 立即关闭煤气阀门 | B. | 立即打开排风扇 | ||
| C. | 立即在家打电话通知煤气管理所 | D. | 用明火查找漏气部位 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
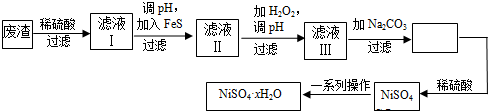
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com