
【题目】Ⅰ.由三种元素组成的化合物 A,按如下流程进行实验:
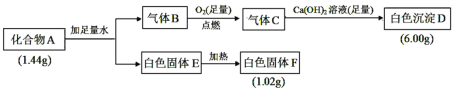
已知:①标准状况下,气体B的密度是氢气的8倍。②固体E既能溶于NaOH溶液又能溶于盐酸。
请回答:
(1)组成 A 的三种元素是__________,A 的化学式是________。
(2)固体 A 与足量稀盐酸反应的化学方程式是__________。
(3)气体 B 与足量 CuO 在加热条件下反应,请写出一个可能的化学方程式________________。
Ⅱ.某兴趣小组为探究 SO2 与 Fe(NO3)3 稀溶液反应的情况,实验装置如图,请回答:
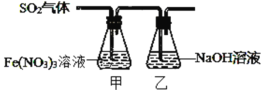
(1)实验过程中,甲中溶液由黄色变为浅绿色但立即又变为黄色。请写出甲中溶液由浅绿色变为黄色的离子方程式_____。
(2)请设计实验方案,检验反应后甲溶液中的金属阳离子______。
【答案】氢、碳、铝 Al(CH3)3 Al(CH3)3+3HCl=AlCl3+3CH4↑ CH4+4CuO![]() 4Cu+CO2+2H2O 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O 取甲中溶液少许,滴入KSCN溶液,若溶液显红色,则存在Fe3+;另取甲中溶液少许,稍加热,滴加酸性高锰酸钾,若紫色褪去(或颜色浅变淡),则说明有Fe2+。(或滴入K3Fe(CN)6溶液,若出现蓝色沉淀,则存在Fe2+)
4Cu+CO2+2H2O 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O 取甲中溶液少许,滴入KSCN溶液,若溶液显红色,则存在Fe3+;另取甲中溶液少许,稍加热,滴加酸性高锰酸钾,若紫色褪去(或颜色浅变淡),则说明有Fe2+。(或滴入K3Fe(CN)6溶液,若出现蓝色沉淀,则存在Fe2+)
【解析】
Ⅰ.化合物A与水反应生成气体B和白色固体E,白色固体E加热可生成白色固体F,白色固体E既能溶于NaOH溶液又能溶于盐酸,说明E具有两性,则E为Al(OH)3,F为Al2O3,则化合物A中含有Al元素,1.02g Al2O3的物质的量为![]() =0.01mol,根据原子守恒,化合物A中的Al元素的物质的量为0.02mol,标准状况下,气体B的密度是氢气的8倍,根据摩尔质量之比等于密度之比,则B的摩尔质量为8×2g/mol=16g/mol,B在足量氧气中燃烧生成的气体C能与Ca(OH)2反应生成白色沉淀,则B为CH4气体,则化合物A中应含有C元素,CH4与足量的氧气完全燃烧生成气体C,C与足量氢氧化钙溶液反应生成白色沉淀D,则D为碳酸钙,6g碳酸钙的物质的量为
=0.01mol,根据原子守恒,化合物A中的Al元素的物质的量为0.02mol,标准状况下,气体B的密度是氢气的8倍,根据摩尔质量之比等于密度之比,则B的摩尔质量为8×2g/mol=16g/mol,B在足量氧气中燃烧生成的气体C能与Ca(OH)2反应生成白色沉淀,则B为CH4气体,则化合物A中应含有C元素,CH4与足量的氧气完全燃烧生成气体C,C与足量氢氧化钙溶液反应生成白色沉淀D,则D为碳酸钙,6g碳酸钙的物质的量为![]() =0.06mol,根据碳原子守恒,则化合物A中的碳元素物质的量为0.06mol,化合物A中第三种元素的质量=1.44g-0.02mol×27g/mol-0.06mol×12g/mol=0.18g,结合物料守恒,化合物A和水反应生成CH4和Al(OH)3,则化合物A中的第三种元素应为H元素,其物质的量为
=0.06mol,根据碳原子守恒,则化合物A中的碳元素物质的量为0.06mol,化合物A中第三种元素的质量=1.44g-0.02mol×27g/mol-0.06mol×12g/mol=0.18g,结合物料守恒,化合物A和水反应生成CH4和Al(OH)3,则化合物A中的第三种元素应为H元素,其物质的量为![]() =0.18mol,则n(H): n(Al): n(C)=0.18mol:0.02mol:0.06mol=9:1:3,根据化合物中元素的正负化合价代数和为零,则可得化合物A的化学式为Al(CH3)3,据此分析解答。
=0.18mol,则n(H): n(Al): n(C)=0.18mol:0.02mol:0.06mol=9:1:3,根据化合物中元素的正负化合价代数和为零,则可得化合物A的化学式为Al(CH3)3,据此分析解答。
Ⅱ.(1)实验过程中,甲中溶液三价铁离子具有氧化性,含有铁离子的溶液为黄色,二氧化硫具有还原性,向甲中通入二氧化硫,发生氧化还原反应生成亚铁离子,含亚铁离子的溶液呈浅绿色,故由黄色变为浅绿色;酸性条件下,硝酸根具有氧化性,可将亚铁离子氧化为铁离子,立即又变为黄色;
(2)反应后甲溶液中的阳离子可能为铁离子或亚铁离子,铁离子能使含有硫氰根离子的溶液变红,亚铁离子具有还原性,据此设计检验方法。
Ⅰ.(1)根据分析,组成 A 的三种元素是氢、碳、铝,A 的化学式是Al(CH3)3;
(2)固体A是Al(CH3)3,与足量稀盐酸反应生成氯化铝和甲烷,化学方程式是Al(CH3)3+3HCl=AlCl3+3CH4↑;
(3)气体 B 为CH4,CH4中的碳为-4价,为碳元素的最低价态,具有还原性,CuO具有氧化性,则CH4与足量 CuO 在加热条件下发生氧化还原反应,可能的化学方程式为CH4+4CuO![]() 4Cu+CO2+2H2O;
4Cu+CO2+2H2O;
Ⅱ.(1)实验过程中,甲中溶液三价铁离子具有氧化性,含有铁离子的溶液为黄色,二氧化硫具有还原性,向甲中通入二氧化硫,发生氧化还原反应生成亚铁离子(反应为SO2+2Fe3++2H2O=SO42-+2Fe2++4H+),含亚铁离子的溶液呈浅绿色,故由黄色变为浅绿色,溶液呈酸性;酸性条件下,硝酸根具有氧化性,可将亚铁离子氧化为铁离子,立即又变为黄色,溶液由浅绿色变为黄色的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(2)由于反应中未指明反应用量,反应后甲溶液中的阳离子可能为铁离子或亚铁离子,铁离子能使含有硫氰根离子的溶液变红,亚铁离子具有还原性,检验反应后甲溶液中的金属阳离子方法为取甲中溶液少许,滴入KSCN溶液,若溶液显红色,则存在Fe3+;另取甲中溶液少许,稍加热,滴加酸性高锰酸钾,若紫色褪去(或颜色浅变淡),则说明有Fe2+。(或滴入K3Fe(CN)6溶液,若出现蓝色沉淀,则存在Fe2+)。


科目:高中化学 来源: 题型:
【题目】已知反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是( )
CO2(g)+H2(g) ΔH<0,在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是( )
A.充入一定量的氮气,n(H2)不变
B.减小压强,n(CO2)增加
C.更换高效催化剂,CO的转化率增大
D.升高温度,K增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(g)+nB(g) ![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是
pC(g)的速率和平衡的影响图像如下,下列判断正确的是
A.由图1可知,T1<T2,该反应正反应为吸热反应
B.由图2可知,该反应m+n﹤p
C.图3中,表示反应速率υ正<υ逆的是点1
D.图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年5月17日新疆电视台(午间新闻)报道:我国新增阿勒泰大气背景监测点。这标志着气候条件独特、空气质量优良的新疆阿勒泰市已成为我国第8个国家大气背景监测点。监测点安装的监测设备可监测日常二氧化硫、二氧化氮、一氧化氮等污染物。NO分子因污染空气而臭名昭著,近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究热点,NO亦被称为“明星分子”。请回答下列问题:
(1)NO对环境的危害在于________(填编号)。
A.破坏臭氧层
B.高温下能使一些金属氧化
C.造成酸雨
D.与人体血红蛋白结合
(2)在含Cu+的酶的活化中心,亚硝酸根离子(NO![]() )可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式:_________________________________________。
)可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式:_________________________________________。
(3)“绿色奥运”是2008年北京奥运会的主题之一,为迎接奥运,减少空气污染,北京为汽车加装了“三效催化净化器”,可将尾气中的一氧化碳和一氧化氮转化为参与大气循环的无毒混合气体,该气体是(______)
A.二氧化碳和氮气 B.二氧化碳和二氧化氮
C.二氧化碳和氧气 D.二氧化碳和氢气
(4)氟利昂(如CCl2F2)可在光的作用下分解,产生氯原子,氯原子会对臭氧层产生长久的破坏作用(臭氧的分子式为O3)。有关反应如下:
O3![]() O2+O Cl+O3=ClO+O2 ClO+O=Cl+O2 总反应:2O3===3O2
O2+O Cl+O3=ClO+O2 ClO+O=Cl+O2 总反应:2O3===3O2
在上述臭氧变成氧气的过程中,Cl是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下图装置中的叙述正确的是

A.这是电解NaOH溶液的装置
B.这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2沉淀的颜色
C.Pt为正极,其电极反应为:O2+2H2O +4e-=4OH-
D.Fe为阳极,其电极反应为:Fe-2e-+2OH-=2Fe(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO是常见的气体污染物,消除NO废气是环境科学研究的热点课题。
(1)H2还原法
已知:①![]()
②![]()
则H2还原NO的热化学方程式为__________________________________。
(2)活性炭还原法
在容积为1L、温度恒定的密闭容中加入1mol NO和足量的活性炭,发生反应C(s) + 2NO(g) ![]() N2(g) + CO2 (g) H,测得物质浓度变化如图所示。
N2(g) + CO2 (g) H,测得物质浓度变化如图所示。
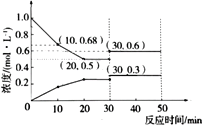
①0-10min内,用活性炭表示的平均反应速率为_________g/min。
②关于该反应的下列叙述正确的是________。
A.压强保持不变说明反应达到平衡
B.混合气体密度保持不变说明反应达到平衡
C.30min时,改变的条件可能是缩小容器体积
D.选择合适的催化剂,能提高NO的平衡转化率
③保持条件不变,若第30min时向容器中加入0.5mol CO2和0.5mol NO,则此时平衡___移动(填“正向”“逆向”或“不”)。判断的依据是_____________________________________。
(3)CO还原法
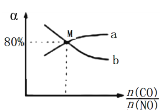
将总物质的量为2mol的CO与NO混合气体充入1L的密闭容器中,发生反应:2NO(g) + 2CO(g) ![]() 2CO2(g) + N2(g),保持温度和压强不变,测得平衡时NO、CO的转化率(α)与CO和NO物质的量比例关系如图。NO的转化率曲线为_____(填“a”或“b”)。M点的起始n(CO)=______mol。该反应的平衡常数K=___________。
2CO2(g) + N2(g),保持温度和压强不变,测得平衡时NO、CO的转化率(α)与CO和NO物质的量比例关系如图。NO的转化率曲线为_____(填“a”或“b”)。M点的起始n(CO)=______mol。该反应的平衡常数K=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学组装了如图所示的电化学装置,电极Ⅰ为Zn,其他电极均为Cu,则下列说法正确的是

A.电子移动:电极Ⅰ→电极Ⅳ→电极Ⅲ→电极Ⅱ
B.电极Ⅰ发生还原反应
C.电极Ⅳ逐渐溶解
D.电极Ⅲ的电极反应:Cu-2e-===Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的信息,下列叙述正确的是( )
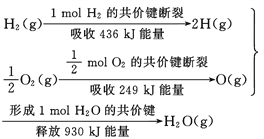
A. 2 mol H2(g)跟 1 mol O2(g)反应生成 2 mol H2O(g)吸收能量为490 kJ
B. 化学反应中能量变化的大小与反应物的质量多少无关
C. 1 mol H2(g) 跟0.5mol O2(g) 反应生成 1 mol H2O(l)释放能量为245 kJ
D. 2molH2O (g)的能量比2 mol H2(g)与1 mol O2(g)的能量之和低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化合物 通过下图的反应过程可以制得化合物E和F,F可使溴的四氯化碳溶液褪色。
通过下图的反应过程可以制得化合物E和F,F可使溴的四氯化碳溶液褪色。
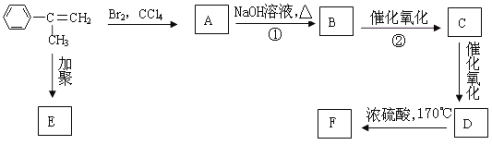
请回答下列问题:
(1)化合物E的结构简式为 :________________。
(2)写出化合物C中含氧官能团的名称:_________________、__________________;F的同分异构体有多种,其中苯环中只含有一个侧链且属于酯类化合物的有: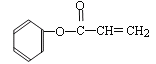 、_________________ 、_________________。(只要求写出其中两种的结构简式)。
、_________________ 、_________________。(只要求写出其中两种的结构简式)。
(3)写出过程①、②的化学反应方程式,并说明反应类型。
①___________________________,反应类型___________________;
②________________________,反应类型_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com