
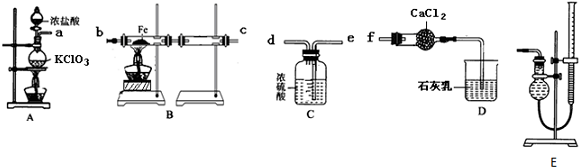
分析 (1)A中氯酸钾与浓盐酸反应生成氯化钾、氯气与水;
(2)A中制备氯气,B中氯气与Fe加热条件下反应生成氯化铁,后面的硬质水管收集氯化铁,氯化铁易潮解,制备的氯气中含有水蒸气,需要进行干燥,C中浓硫酸干燥氯气,氯气有毒会污染空气,D吸收尾气中氯气,干燥管中氯化钙吸收水蒸气,防止加入B中;
(3)装置中含有空气,B中加热时氧气能与Fe反应,先用氯气排尽装置中空气后,再反应制备氯化铁;
(4)B装置两硬质玻璃管之间导管太细,易被产品堵塞;
(5)D中氢氧化钙与氯气反应生成氯化钙、次氯酸钙与水;
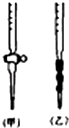
(6)①由滴定管的结构,应是碱式滴定管;
②用饱和的氯化钠溶液,降低氯气的溶解度;读数时应左右两边液面相平;
③第一次与最后读数之差为测定气体的体积,最后读数时俯视右边滴定管液面时,读数偏小,测定气体的体积偏大.
解答 解:(1)A中氯酸钾与浓盐酸反应生成氯化钾、氯气与水,反应方程式为:KClO3+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$KCl+3Cl2↑+3H2O,
故答案为:KClO3+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$KCl+3Cl2↑+3H2O;
(2)A中制备氯气,B中氯气与Fe加热条件下反应生成氯化铁,后面的硬质水管收集氯化铁,氯化铁易潮解,制备的氯气中含有水蒸气,需要进行干燥,C中浓硫酸干燥氯气,氯气有毒会污染空气,D吸收尾气中氯气,干燥管中氯化钙吸收水蒸气,防止加入B中,各装置的连接顺序为a→e→d→b→c→f,
故答案为:e、d、b、c、f;
(3)装置中含有空气,B中加热时氧气能与Fe反应,先用氯气排尽装置中空气,实验过程中给A、B仪器加热的顺序及可作为点燃B处酒精灯的实验标志是:先点然A处酒精灯,反应一段时间后,待整个B装置充满黄绿色气体,再加热B,
故答案为:先点然A处酒精灯,反应一段时间后,待整个B装置充满黄绿色气体,再加热B;
(4)B装置的主要缺点是:B装置两硬质玻璃管之间导管太细,易被产品堵塞,
故答案为:B装置两硬质玻璃管之间导管太细,易被产品堵塞;
(5)D中氢氧化钙与氯气反应生成氯化钙、次氯酸钙与水,反应方程式为:2 Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2 Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O;
(6)①由滴定管的结构,所用滴定管为碱式滴定管,
故答案为:碱式;
②用饱和的氯化钠溶液,降低氯气的溶解度;读数时应上下移动滴定管,使左右两边液面相平,保持内外气压相等,
故答案为:饱和氯化钠溶液;上下移动滴定管,使左右两边液面相平;
③滴定管刻度由上而下增大,最后读数时俯视右边滴定管液面时,读数偏小,第一次与最后读数之差为测定气体的体积,测定气体的体积偏大,
故答案为:偏大.
点评 本题考查物质制备实验,涉及氯气制备、对装置的分析评价、信息获取与迁移应用、气体体积测定等,关键是明确实验原理,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | M的氢化物的水溶液能与W的钠盐溶液,反应得到W的氢化物,说明非金属性M>W | |
| B. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) | |
| C. | Y与Z形成的化合物能与碱反应,但不能和任何酸反应 | |
| D. | X和Y,W和M均能形成原子个数比为1:1的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4:10 | B. | 10:4 | C. | 4:1 | D. | 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 | IA | ⅡA | ⅢA | ⅣA | VA | VIA | VⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 把金属铁放入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 往碳酸镁中滴加稀盐酸:MgCO3+2H+═CO2↑+H2O+Mg2+ | |
| C. | 向氢氧化铜中滴加稀盐酸:Cu(OH)2+2H+═Cu2++2H2O | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com