
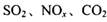 是对环境影响较大的儿种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。
是对环境影响较大的儿种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。 浓度的有__________ (选填字母)。
浓度的有__________ (选填字母)。


 条件下,
条件下,
 ,其平衡常数K=13.3。
,其平衡常数K=13.3。 ,则
,则 =_______________(保留两位有效数字)。
=_______________(保留两位有效数字)。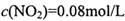 ,
, ,则改变的条件是____________________
,则改变的条件是____________________ 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源:不详 题型:单选题
| A.2H2(g)+O2(g) ="=" 2H2O(1)△H= ―285.8kJ/mol |
| B.2H2(g)+ O2(g) ="=" 2H2O(1)△H= +571.6 kJ/mol |
| C.2H2(g)+O2(g) ="=" 2H2O(g)△H= ―571.6 kJ/mol |
| D.H2(g)+1/2O2(g) ="=" H2O(1)△H= ―285.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H =-566kJ·mol-1 N2(g)+O2(g)="2NO" (g)
H =-566kJ·mol-1 N2(g)+O2(g)="2NO" (g)  H =+180kJ·mol-1则2CO(g)+2NO(g)=N2(g)+2CO2(g)的
H =+180kJ·mol-1则2CO(g)+2NO(g)=N2(g)+2CO2(g)的 H是
H是| A.-386 kJ·mol-1 | B.+386 kJ·mol-1 |
| C.-746 kJ·mol-1 | D.+746 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
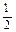 O2(g) =" CO" (g)
O2(g) =" CO" (g) 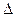 H1= —110.5kJ/mol
H1= —110.5kJ/mol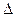 H2= —393.5kJ/mol
H2= —393.5kJ/mol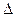 H为
H为| A.+ 283.5kJ/mol | B.+ 172.5kJ/mol |
| C.—172.5kJ/mol | D.—504kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 联氨(N2H4) 为燃料、过氧化氢为助燃剂。已知下列各物质反应的热化学方程式:
联氨(N2H4) 为燃料、过氧化氢为助燃剂。已知下列各物质反应的热化学方程式:| A.N2H4(g)+2H2O2(l)= N2(g)+4H2O(l)ΔH=-817.63 kJ·mol-1 |
| B.N2H4(g)+2H2O2(l)= N2(g)+4H2O(g)ΔH=-817.63 kJ·mol-1 |
| C.N2H4(g)+2H2O2(l)= N2(g)+4H2O(l)ΔH=-641.63 kJ·mol-1 |
D.N2H4(g)+2H2O2(l)= N2(g)+4H2O( g)ΔH=-641.63 kJ·mol-1 g)ΔH=-641.63 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.CH4 ( g )+2NO2 ( g )= N2( g )+C O2 ( g )+2H2O ( l)△H=一867 kJ·mol-1 O2 ( g )+2H2O ( l)△H=一867 kJ·mol-1 |
| B.CH4 ( g )+2NO2 ( g )= N2( g )+CO2 ( g )+2H2O ( g)△H=一867 kJ·mol-1 |
C.CH4 ( g )+2NO2 ( g )= N2( g )+CO2 ( g )+2H2O ( g)△H=一586kJ·mol -1 -1 |
| D.CH4 ( g )+2NO2 ( g )= N2( g )+CO2 ( g )+2H2O ( g)△H=+586kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Q1 > Q2 | B.Q1 = Q2 | C.2Q1 < Q2 | D.Q1 = 1/2Q2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com