
【题目】按以下步骤可从某烃A合成一种染料中间体DSD酸。(试剂和条件已略去)
A![]() B
B![]() CD
CD
已知:
①B的结构简式为![]()
②![]()
![]()
![]()
③![]()
![]()
![]() (-NH2易被NaClO氧化)
(-NH2易被NaClO氧化)
④2![]()
![]()

请回答下列问题
(1)A的结构简式_____________________________________;
(2)C的结构简式_____________________________________;
(3)D的结构简式_____________________________________。
(4)A到B的反应方程式为_____________________________________
【答案】


![]() + HNO3
+ HNO3![]()
![]() + H2O
+ H2O
【解析】
由题意可知A→B为硝化反应,B→C为磺化反应(即信息②),这样得到含1个苯环的化合物C。由C→D或D→DSD酸是根据信息③实现的,但如果把它放到最后一步,则强氧化剂NaClO必将会氧化苯胺(由信息③苯胺易氧化的性质可知)。所以确定C→D发生了类似于③的反应,而最后一步发生的是类似于③的反应。根据上述讨论可推出确定答案。
由信息反应④可知,反应使用NaClO,NaClO具有强氧化性,由信息反应③可知,苯胺易被氧化,故合成路线中应先发生反应④类型的转化,后发生反应③类型的转化,故结合反应路线可知,A生成B发生硝化反应,B生成C发生反应②类型的转化,C生成D发生反应④类型的转化,D生成DSD酸发生反应③类型的转化,由DSD酸的结构,利用倒推法确定各物质的结构可知,D为  ,故C为
,故C为 ,B为
,B为![]() ,A为
,A为 ,
,
故答案为:  ;
; ;
; ;
;![]() + HNO3
+ HNO3![]()
![]() + H2O。
+ H2O。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】丙烯是一种重要的化工原料。可由丙烷催化脱氢制备。
主反应:①C3H8(g)=C3H6(g)+H2(g) ΔH1
副反应:②C3H8(g)=C2H4(g)+CH4(g)
③C2H4(g)+H2(g)=C2H6(g)
④C3H8(g)+H2(g)=C2H6(g)+CH4(g)
回答下列问题:
(1)已知:C3H8(g)+![]() O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/mol
O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/mol
H2(g)+![]() O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=___。
O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=___。
(2)某温度下,在体积不变的密闭容器内发生反应①,起始总压强为105Pa,平衡时总压增加了20%。则C3H8的转化率为___;该反应的平衡常数Kp=___Pa。若提高C3H8的平衡转化率,可采取的措施有___(填标号)。
A.增大C3H8的浓度
B.提高温度
C.恒容下通入惰性气体
D.使用高效催化剂
(3)工业生产中常采用恒压下充入高温水蒸气的条件。如图表示常压下反应①C3H8的平衡转化率与温度及水烃比(M)的关系,M2___5(填“>”或“<”)。
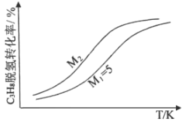
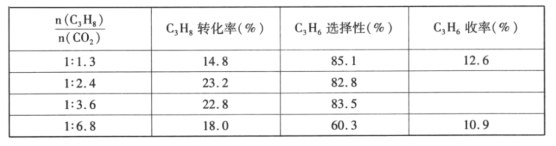
(4)已知高温下C-C键断裂反应比C-H键断裂的脱氢反应容易发生,这将导致丙烯选择性降低;同时高温加剧催化剂表面积炭,导致催化剂迅速失活。在生产中充入CO2的作用之一是利于催化剂活性保持,其原因是___。反应气中![]() 的配比对催化剂活性的影响如表所示。其中C3H6收率最高时
的配比对催化剂活性的影响如表所示。其中C3H6收率最高时![]() 的配比是___。
的配比是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质的电子式:
(1)Cl2____________ (2)N2___________ (3)H2O___________
(4)NaOH __________(5)CH4___________ (6)CO2__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为验证元素周期表中元素性质的递变规律,利用右图装置可验证同主族非金属性的变化规律。设计了如下系列实验。
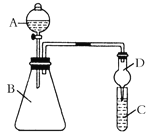
(1)向Na2S溶液中通入氯气出现淡黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为____________________________________________。
(2)仪器A的名称为____________________,
(3)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4, (KMnO4 与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到混合溶液 的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用______________溶液吸收尾气。
(4)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3,C中加Na2SiO3 溶液观察到C中溶液_____________的现象,即可证明。但有的同学认为盐酸具有挥发性,应用__________溶液除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生探究如下实验(A):
实验A | 条件 | 现象 |
| 加热 | i.加热后蓝色褪去 ii.冷却过程中,溶液恢复蓝色 ⅲ.一段时间后,蓝色重又褪去 |
(1)使淀粉变蓝的物质是____。
(2)分析现象i、ii认为:在酸性条件下,加热促进淀粉水解,冷却后平衡逆向移动。
设计实验如下,“现象a”证实该分析不合理:

“现象a”是____。
(3)再次分析:加热后单质碘发生了变化,实验如下:
I:取少量碘水,加热至褪色,用淀粉溶液检验挥发出的物质,变蓝。
Ⅱ:向褪色后的溶液中滴加淀粉溶液,冷却过程中一直未变蓝;加入稀H2SO4,瞬间变蓝。
对步骤Ⅱ中稀H2SO4的作用,结合离子方程式,提出一种合理的解释:______________。
(4)探究碘水褪色后溶液的成分:
实验1:测得溶液的pH≈5
实验2:取褪色后的溶液,完成如下实验:

①产生黄色沉淀的离子方程式是____。
②Ag2O的作用是____________。
③依据上述实验,推测滤液中含有的物质(或离子)可能是_________。
(5)结合化学反应速率解释实验A中现象i、现象iii蓝色褪去的原因:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴奋剂是体育比赛中禁用的药物,有一种兴奋剂的结构如图。关于它的说法中正确的是

A.该有机物能发生银镜反应
B.分子中有 4 个碳碳双键
C.既能被还原,又能被氧化
D.1mol 该物质最多跟 6mol 氢气发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有mA(s)+nB(g)qC(g) △H<0的可逆反应,在一定温度下达平衡时,B的体积分数ф(B)和压强p的关系如图所示,则下列有关该反应的描述正确的是( )
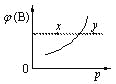
A. m+n<qB. n>q
C. x点的混合物中v (正)<v (逆)D. x点比y点的混合物的正反应速率小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学取一定量淀粉进行水解实验,其实验步骤如下所示:

请回答下列问题:
① 所加入的试剂分别是
A_______,B________,C________;
② 加B的原因是_____________________________________________________;
③由此可知淀粉是________(填“部分”、“完全”或“没有”)水解。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题。
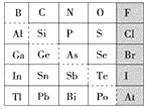
(1)元素Ga在元素周期表中的位置为:第_____周期第____族。
(2)Sn的最高正价为____,Cl的最高价氧化物对应水化物的化学式为___,Bi的最高价氧化物为_____。
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是______元素(填元素符号)。
②H3AsO4、H2SeO4的酸性强弱:H3AsO4______H2SeO4(填“>”“<”或“=”)。
③氢化物的还原性:H2O______H2S(填“>”“<”或“=”)。
④原子半径比较:N______Si(填“>”“<”或“=”)。
(4)可在图中分界线(虚线部分)附近寻找______(填序号)。
A.优良的催化剂 B.半导体材料C.合金材料 D.农药
(5)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)________。
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com