
【题目】水的硬度过高对工业生产有严重危害,可降低水的硬度的方法是( )
A.过滤法B.中和法C.离子交换法D.明矾净化法
科目:高中化学 来源: 题型:
【题目】已知A为常见的金属单质,根据下图所示的关系:
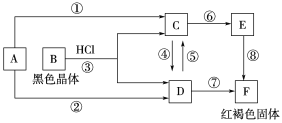
(1)确定A、C、E的化学式:
A.____________, C.____________, F.____________。
(2)写出反应⑧的化学方程式___________________________________,
反应④、⑤的离子方程式______________________、______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC类似pH,是指溶液中溶质物质的量浓度的常用对数的负值,如某溶液的浓度为1×10-2mol/L,则溶液中该溶质的pC=-lg1×10-2=2。已知H2RO3溶液中存在的化学平衡为:
RO2(g)+H2O ![]() H2RO3
H2RO3 ![]() H+ +HRO3- ,HRO3-
H+ +HRO3- ,HRO3-![]() H++RO32-。下图为H2RO3饱和溶液的pC-pH图。请回答下列问题:
H++RO32-。下图为H2RO3饱和溶液的pC-pH图。请回答下列问题:
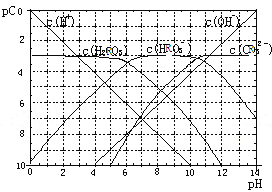
(1)在pH=2~4时,H2RO3溶液中主要存在的离子为:_____;
(2)H2RO3一级电离平衡常数的数值Ka1≈_______;
(3)已知:298K时,H2RO3的电离常数Ka2=5.6×10-11。观察上图判断NaHRO3溶液呈_______性;再通过计算,利用电离、水解平衡常数说明理由____________。
(4)一定浓度的NaHRO3和Na2RO3混合溶液是一种“缓冲溶液”,在这种溶液中加入少量的强酸或强碱,溶液的pH变化不大,其原因是_________ 。
(5)一定温度下,三种盐MRO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解曲线如图所示。已知:p(M2+)=-lg c(M2+),p(RO32-)= -lgc(RO32-)
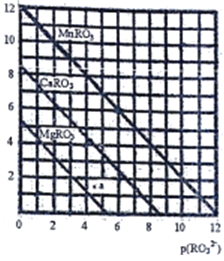
①MgRO3、CaRO3、MnRO3的Ksp由大到小的顺序为__________________。
② a 点时c(Mg2+)_____ c(RO32-) (填“>”或“<”或“=”),此时MgRO3溶液__________(填“己达饱和”或“未达饱和”)
③现欲将某溶液中的Mn2+以MnRO3盐的形式沉淀完全(溶液中Mn2+离子的浓度小于l×10-5mol/L),则最后溶液中的p(RO32-)的范围是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮是动植物体中的重要组成元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会产生光化学烟雾,目前,这些有毒有害气体的处理成为科学研究的重要内容。
(1)已知热化学方程式:①2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH1
②C(s)+O2(g)===CO2(g) ΔH2
③H2(g)+1/2O2(g)===H2O(l) ΔH3
则反应④2C(s)+H2(g)===C2H2(g)的ΔH=_________。(用含ΔH1、ΔH2、ΔH3的关系式表示)
(2)利用上述反应①设计燃料电池(电解质溶液为氢氧化钾溶液),写出电池的负极反应式:__________________________________________ 。
(3)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH<0。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) ΔH<0。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间/min 浓度/(mol·L-1) 物质 | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①10~20 min内,NO的平均反应速率v(NO)=______,T1℃时,该反应的平衡常数K=________。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是________(填字母编号)。
a.通入一定量的NO b.加入一定量的C c.适当升高反应体系的温度
d.加入合适的催化剂 e.适当缩小容器的体积
③若保持与上述反应前30 min的反应条件相同,起始时NO的浓度为2.50 mol·L-1,则反应达平衡时c(NO)=________,NO的转化率=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为四种短周期元素,它们的原子序数依次增大,其中A与C、B与D分别是同主族元素;已知B、D两元素间可形成DB2和DB3两种化合物,两者相对分子质量相差16;又知A、C两元素原子序数之和是B、D两元素原子序数之和的![]() ,请回答下列问题:
,请回答下列问题:
(1)写出由A、B、C三种元素形成的化合物的电子式:__________________________,其晶体中所含化学键的类型有________________________________________________________。
(2)A2B的沸点比A2D的沸点(填“高”或“低”)________;其原因是_________________。
(3)由A、B、C、D四种元素形成的物质X,与盐酸反应能够生成具有刺激性气味的气体,写出X与盐酸反应的离子方程式:___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是

已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3 ℃;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,溶解度为0.34 g;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:

试根据上述信息回答下列问题:
(1)操作Ⅰ的名称是________,乙醚溶液中所溶解的主要成分是________。
(2)操作Ⅱ的名称是________,产品甲是________。
(3)操作Ⅲ的名称是________,产品乙是________。

(4)如图所示,操作Ⅱ中温度计水银球上沿放置的位置应是________(填“a”“b”“c”或“d”),该操作中,除需蒸馏烧瓶、温度计外,还需要的玻璃仪器是__________________,收集产品甲的适宜温度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种烃,其球棍模型如下图:
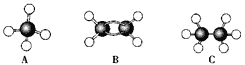
(1)等质量的以上物质完全燃烧时耗去O2的量最多的是________(填对应字母,下同);
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是____________;
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是________,生成水最多的是________。
(4)在120℃、1.01×105 Pa下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与盐类水解无关的是( )
A.明矾可以净水
B.使用热的纯碱溶液去除油污效果好
C.实验室配制 FeCl2 溶液时加入少量稀盐酸
D.向 FeCl3 溶液中加入 KOH 溶液产生红褐色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com