
分析 (1)配制0.2mol/L的CuSO4溶液500ml,需要CuSO4的物质的量=0.5L×0.2mol/L=0.1mol,根据m=nM进行计算;
(2)根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断.
解答 解:(1)配制0.2mol/L的CuSO4溶液500ml,需要CuSO4的物质的量=0.5L×0.2mol/L=0.1mol,所以质量为:0.1mol×160g/mol=16g,故答案为:16g;
(2)①溶解后转移有液体滴到容量瓶外,导致溶质的物质的是量减少,所以所配溶液浓度偏低,故答案为:偏低;
②定容时俯视,导致溶液的体积变小,所以配溶液的浓度偏高,故答案为:偏高;
③最终要加水定容,所以开始时容量瓶中有水,对所配溶液无影响,故答案为:无影响.
点评 本题考查了一定物质的量浓度溶液的配制过程、仪器以及误差分析,难度不大,注意实验的基本操作方法和注意事项.


科目:高中化学 来源: 题型:选择题
| A. | X的最高价氧化物对应的水化物是弱酸 | |
| B. | Z位于元素周期表的第3周期第ⅥA族 | |
| C. | Y的最高氧化物对应的水化物能溶于NaOH溶液 | |
| D. | 原子半径的大小顺序:r(Z)>r(Y)>r(X) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯净物是指由同种元素组成的物质 | B. | 由同种元素组成的纯净物叫单质 | ||
| C. | 由不同种分子组成的物质叫化合物 | D. | 一种元素只能组成一种单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/L | B. | 1.0mol/L | C. | 1.5mol/L | D. | 3.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
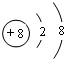 .
.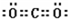 .
.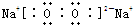 ,其中含有的化学键有离子键、共价键.用电子式表示B、D的单质在常温下反应生成的化合物的形成过程:
,其中含有的化学键有离子键、共价键.用电子式表示B、D的单质在常温下反应生成的化合物的形成过程: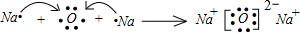 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
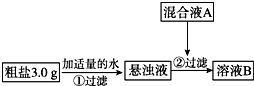 目前国内外使用的融雪剂一般有两大类:一类是以醋酸钾为主要成分的有机融雪剂;另一类是以“氯盐”为主要成分的无机融雪剂,如氯化钠、氯化钙、氯化镁等,通称“化冰盐”.某研究性学习小组拟对融雪氯盐(如图称为粗盐)(主要含有氯化钠及不溶性杂质、Mg2+、Ca2+等)进行回收提纯研究.
目前国内外使用的融雪剂一般有两大类:一类是以醋酸钾为主要成分的有机融雪剂;另一类是以“氯盐”为主要成分的无机融雪剂,如氯化钠、氯化钙、氯化镁等,通称“化冰盐”.某研究性学习小组拟对融雪氯盐(如图称为粗盐)(主要含有氯化钠及不溶性杂质、Mg2+、Ca2+等)进行回收提纯研究.| 化学式 | CaCO3 | CaSO3 | CaC2O4 | Mg(OH)2 |
| Ksp | 2.8×10-9 | 6.8×10-8 | 4.0×10-9 | 1.8×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应为:14H2O+7O2+28e-=28OH- | |
| B. | 放电一段时间后,负极周围的pH升高 | |
| C. | 放电过程中OH-向正极移动 | |
| D. | 每消耗1mol C2H6,则电路上转移的电子为14mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com