
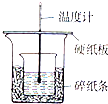
 实验室利用如图装置进行中和热的测定,请回答下列问题:
实验室利用如图装置进行中和热的测定,请回答下列问题: ;
;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
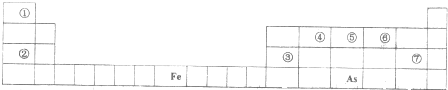
| 编号 | a的取值范围 | 产物的化学式(或离子符号) |
| A | a≤1/6 | I2 Br- H2O |
| B | 1/6<a<1/5 | |
| C | a=1/5 | I2 Br2 H2O |
| D | 1/5<a<6/5 | I2 IO3- Br2 H2O |
| E | a≥6/5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
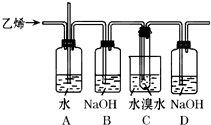 已知1,2-二溴乙烷的主要物理性质如表:
已知1,2-二溴乙烷的主要物理性质如表:| 熔点 | 沸点 | 密度 | 溶解性 |
| 9.79°C | 131.4°C | 2.18g/cm3 | 难溶于水,易溶于醇、醚等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | |
| 盐酸 | NaOH | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
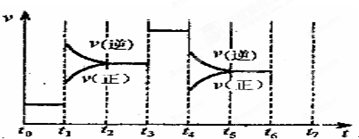
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、P4是非极性分子,磷原子处在正方形4个角上 |
| B、H2O是极性分子,氧原子不处在2个氢原子所连成的直线的中央 |
| C、CCl4是非极性分子,碳原子处在4个氯原子所组成的正方形的中心 |
| D、CO2是极性分子,碳原子处在2个氧原子所连成的直线的中央 |
| E、CO2是极性分子,碳原子处在2个氧原子所连成的直线的中央 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com