
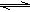 Fe(SCN)3+3KCl,这是一个可逆反应,其离子方程式为Fe3++3SCN-
Fe(SCN)3+3KCl,这是一个可逆反应,其离子方程式为Fe3++3SCN- Fe(SCN)3,它表明:K+与Cl-没有参加离子反应,在所得的血红色溶液中加入少量KCl晶体后,平衡不会发生移动,溶液中的血红色物质Fe(SCN)3的浓度没有发生变化,所以甲试管中溶液的颜色不变。乙试管中通入SO2气体时,由于Fe3+的氧化性较强,能将+4价的硫氧化为+6价的硫,其离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,这个反应的发生减小了平衡体系中Fe3+的浓度,平衡左移,所以乙试管中溶液的颜色变浅。需注意SO2的漂白性――只能漂白“某些有色物质”,并不能漂白所有的有色物质。
Fe(SCN)3,它表明:K+与Cl-没有参加离子反应,在所得的血红色溶液中加入少量KCl晶体后,平衡不会发生移动,溶液中的血红色物质Fe(SCN)3的浓度没有发生变化,所以甲试管中溶液的颜色不变。乙试管中通入SO2气体时,由于Fe3+的氧化性较强,能将+4价的硫氧化为+6价的硫,其离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,这个反应的发生减小了平衡体系中Fe3+的浓度,平衡左移,所以乙试管中溶液的颜色变浅。需注意SO2的漂白性――只能漂白“某些有色物质”,并不能漂白所有的有色物质。

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源:专项题 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com