
 C中含氧官能团的名称为羰基.
C中含氧官能团的名称为羰基.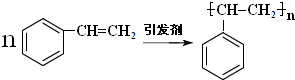 .G与新制Cu(OH)2悬浊液反应的化学方程式
.G与新制Cu(OH)2悬浊液反应的化学方程式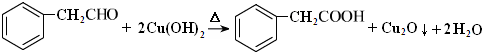 .
.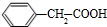 +
+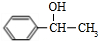 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$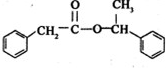 +H2O
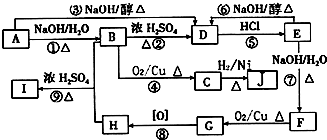
+H2O分析 A与E都属于芳香族化合物且互为同分异构体,A碱性水解得B,B在浓硫酸作用下发生消去反应得D,D的最简式与乙炔相同,且相对分子质量为104,设C的化学式为(CH)n,则13n=104,所以n=8,则D的化学式是C8H8,D结构简式为: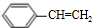 ,D和氯化氢发生加成反应生成氯代烃E,E和氢氧化钠的水溶液发生取代反应生成醇F,F被氧化生成G,G能和新制氢氧化铜反应生成砖红色沉淀,则G中含有醛基,所以G是
,D和氯化氢发生加成反应生成氯代烃E,E和氢氧化钠的水溶液发生取代反应生成醇F,F被氧化生成G,G能和新制氢氧化铜反应生成砖红色沉淀,则G中含有醛基,所以G是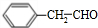 ,F是
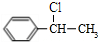
,F是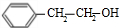 ,E的结构简式为:
,E的结构简式为: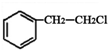 ,G被氧化生成H,则H是
,G被氧化生成H,则H是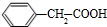 .A和E是同分异构体,A发生消去反应得到苯乙烯,则A的结构简式为:
.A和E是同分异构体,A发生消去反应得到苯乙烯,则A的结构简式为: ,A和氢氧化钠的水溶液发生取代反应生成B,B的结构简式为:
,A和氢氧化钠的水溶液发生取代反应生成B,B的结构简式为: ,B被氧气生成C,C的结构简式为:
,B被氧气生成C,C的结构简式为: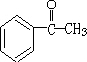 ,C与氢气加成生成J为
,C与氢气加成生成J为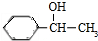 ,B与H反应生成I,则I的结构简式为:
,B与H反应生成I,则I的结构简式为: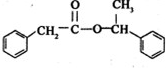 ,据此解答.
,据此解答.
解答 解:A与E都属于芳香族化合物且互为同分异构体,A碱性水解得B,B在浓硫酸作用下发生消去反应得D,D的最简式与乙炔相同,且相对分子质量为104,设C的化学式为(CH)n,则13n=104,所以n=8,则D的化学式是C8H8,D结构简式为: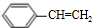 ,D和氯化氢发生加成反应生成氯代烃E,E和氢氧化钠的水溶液发生取代反应生成醇F,F被氧化生成G,G能和新制氢氧化铜反应生成砖红色沉淀,则G中含有醛基,所以G是
,D和氯化氢发生加成反应生成氯代烃E,E和氢氧化钠的水溶液发生取代反应生成醇F,F被氧化生成G,G能和新制氢氧化铜反应生成砖红色沉淀,则G中含有醛基,所以G是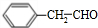 ,F是
,F是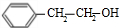 ,E的结构简式为:
,E的结构简式为: ,G被氧化生成H,则H是
,G被氧化生成H,则H是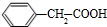 .A和E是同分异构体,A发生消去反应得到苯乙烯,则A的结构简式为:
.A和E是同分异构体,A发生消去反应得到苯乙烯,则A的结构简式为: ,A和氢氧化钠的水溶液发生取代反应生成B,B的结构简式为:
,A和氢氧化钠的水溶液发生取代反应生成B,B的结构简式为: ,B被氧气生成C,C的结构简式为:
,B被氧气生成C,C的结构简式为: ,C与氢气加成生成J为
,C与氢气加成生成J为 ,B与H反应生成I,则I的结构简式为:
,B与H反应生成I,则I的结构简式为: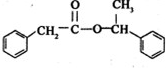 .
.
(1)根据上面的分析可知,A的结构简式为 ,C的结构简式为:
,C的结构简式为: ,所以C中含氧官能团的名称为 酮羰基,
,所以C中含氧官能团的名称为 酮羰基,
故答案为: ;酮羰基;
;酮羰基;
(2)根据官能团的变化、反应条件可知,属于取代反应的有①⑦⑨,反应④⑧属于氧化反应,反应②③⑥属于消去反应,反应⑤属于加成反应,
故答案为:①⑦⑨;
(3)D为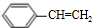 ,D可以发生加聚反应生成高聚物,反应的化学方程式为
,D可以发生加聚反应生成高聚物,反应的化学方程式为 ;
;
G与新制Cu(OH)2悬浊液反应的化学方程式为 ;
;
B+H反应的化学方程式: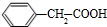 +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$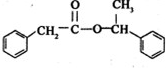 +H2O,
+H2O,
故答案为: ;
; ;
;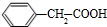 +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$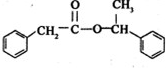 +H2O;
+H2O;
(4)H为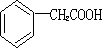 ,其同分异构体苯环上含有两个取代基且能与NaOH溶液反应,但不与FeCl3溶液发生显色反应,说明苯环上不含羟基,其中一个取代基为甲基,另一取代基可为-COOH或-OOCH,各有邻、间、对三种,共6种,
,其同分异构体苯环上含有两个取代基且能与NaOH溶液反应,但不与FeCl3溶液发生显色反应,说明苯环上不含羟基,其中一个取代基为甲基,另一取代基可为-COOH或-OOCH,各有邻、间、对三种,共6种,
故答案为:6.
点评 本题考查有机物的推断,难度中等,关键是确定D的结构简式,再根据有机物官能团的性质以及反应条件进行推断,需要学生熟练掌握官能团的性质与转化.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 物质的熔点:石英>食盐>冰>汞 | |
| B. | 热稳定性:PH3>H2S>HBr>NH3 | |
| C. | 微粒半径由大到小顺序是:H->Li+>H+ | |
| D. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 投料比$\frac{n{H}_{2}p}{nC{O}_{2}p}$ | 500K | 600K | 700K |
| 1.5 | 45% | 33% | 20% |
| x | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,将1.12L Cl2溶于水,转移电子数为0.05NA | |
| B. | 将含等物质的量的KHCO3和Ba(OH)2溶液混合,离子方程式为:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| C. | 常温下,由水电离出的H+浓度为10-13mol•L-1的溶液中,Fe2+、Cl-、Na+、NO3-一定能大量共存 | |
| D. | 葡萄糖(C6H12O6)溶液中:SO42-、MnO4-、K+、H+可以大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.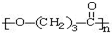 ),它可代替F,以减少“白色污染”. 聚丁内酯可用环丁内酯开环聚合而成,其工业生产方法和降解原理如下:
),它可代替F,以减少“白色污染”. 聚丁内酯可用环丁内酯开环聚合而成,其工业生产方法和降解原理如下: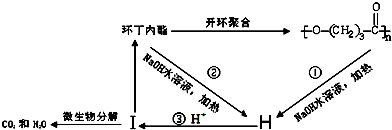
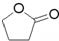 .
. .
.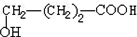 +9O2$\stackrel{微生物}{→}$8CO2↑+8H2O.
+9O2$\stackrel{微生物}{→}$8CO2↑+8H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
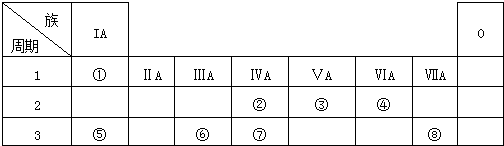
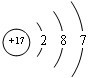 .
. ,②和⑦的气态氢化物的稳定性相比,其中较弱的是SiH4 (用该氢化物的化学式表示).
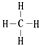
,②和⑦的气态氢化物的稳定性相比,其中较弱的是SiH4 (用该氢化物的化学式表示).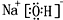 ,形成的晶体是离子晶体.
,形成的晶体是离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,E元素的周期表位置第三周期ⅥA族,乙的电子式为
,E元素的周期表位置第三周期ⅥA族,乙的电子式为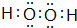 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 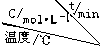 | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | c2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | c3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com