(2012?永州模拟)现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子 Na
+、Al
3+、Mg
2+、Ba
2+、Fe
3+和五种阴离子Cl
-、OH
-、NO
3-、CO
32-、X中的一种.
(1)某同学通过分析,认为无需检验就可判断其中必有的两种物质是
Na2CO3
Na2CO3
和
Ba(OH)2
Ba(OH)2
(填化学式).
(2)为了确定X,现将(1)中的两种物质记为A和B,含X的物质记C,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时也产生红褐色沉淀,向该沉淀中滴入稀硝酸沉淀部分溶解,最后留有白色沉淀不再溶解.则X为
B
B
.
A.SO
32-B.SO
42-C.CH
3COO
-D.SiO
32-(3)B的水溶液显
碱性
碱性
性,原因为
CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
.(用离子方程式表示)
(4)将0.02molA与0.01molC同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的物质的量为
6.1g
6.1g
(保留一位小数)
(5)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀H
2SO
4,Cu逐渐溶解,管口附近有红棕色气体出现.则物质D一定含有上述离子中的
NO3-
NO3-
(填相应的离子符号).有关反应的离子方程式为:
3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
.
(6)利用上述已经确定的物质,可以检验出D、E中的阳离子.请简述实验操作步骤、现象及结论
取少量D的溶液与试管中,逐渐进入Ba(OH)2溶液至过量,先出现白色沉淀后溶解,则D中含有Al3+,若生成的白色沉淀不溶解,则D中含有Mg2+
取少量D的溶液与试管中,逐渐进入Ba(OH)2溶液至过量,先出现白色沉淀后溶解,则D中含有Al3+,若生成的白色沉淀不溶解,则D中含有Mg2+
.

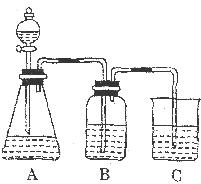 为了确定CH3COOH、
为了确定CH3COOH、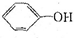 及H2CO3的酸性强弱,有人设计了如图所示的装置进行实验:
及H2CO3的酸性强弱,有人设计了如图所示的装置进行实验:

 计算高手系列答案
计算高手系列答案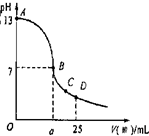 现有一瓶浓度为0.2mol/L的某酸溶液,可能为醋酸、盐酸、硫酸中的一种.
现有一瓶浓度为0.2mol/L的某酸溶液,可能为醋酸、盐酸、硫酸中的一种.