
| A、常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA |
| B、78 g苯含有C=C双键的数目为3 NA |
| C、1 L 1 mol?L-1的NaClO溶液中含有ClO-的数目为NA |
| D、标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1 NA |
| V |
| 22.4 |
| 14g |
| 28g/mol |
| 6.72L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、①④ | B、②④ | C、①③ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5mol |
| B、0.8mol |
| C、1.1mol |
| D、1.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO3溶于水后能导电,故SO3为电解质 |
| B、强电解质的水溶液中不存在大量溶质分子 |
| C、向NaCN溶液中滴入酚酞试液显红色,则HCN为强酸 |
| D、25℃时,用CH3COOH溶液滴定等浓度NaOH溶液至pH=7,V(CH3COOH)<V(NaOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
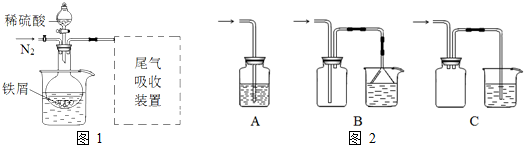
查看答案和解析>>
科目:高中化学 来源: 题型:
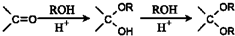
 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com