
A、用浓硫酸与4-溴-1-丁醇加热发生消去反应:BrCH2CH2CH2OH
| |||
B、水杨酸( )中加入NaHCO3溶液: )中加入NaHCO3溶液: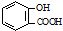 +2HCO3→ +2HCO3→ +2CO2↑+2H2O +2CO2↑+2H2O | |||
| C、在氢氧化钡溶液中滴加硫酸氢钾溶液至pH=7:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |||
| D、用侯氏制碱法制得NaHCO3:Na++NH3+CO2+H2O=NaHCO3↓+NH4+ |
| 浓硫酸 |
| △ |
 )中加入NaHCO3溶液反应,化学方程式为:
)中加入NaHCO3溶液反应,化学方程式为: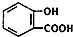 +HCO3-→+CO2↑+H2O,故B错误;
+HCO3-→+CO2↑+H2O,故B错误;

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
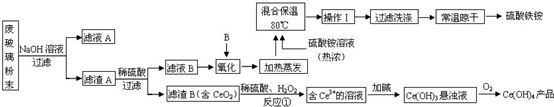

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酯化反应、硝化反应以及酯的水解均属于取代反应类型 |
| B、乙醇生成溴乙烷和乙烯生成溴乙烷的反应类型相同 |
| C、可用氢氧化钠溶液除去乙酸乙酯中混有乙酸和乙醇 |
| D、蛋白质、淀粉、油脂均属于天然高分子化合物,均能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
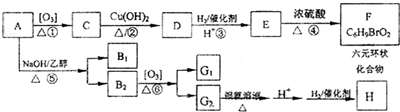
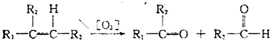
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、工作一段时间后,C烧杯的PH减小 |
| B、电极I发生还原反应 |
| C、盐桥中的K+移向A烧杯 |
D、电流方向:电极Ⅳ→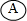 →电极I →电极I |
查看答案和解析>>
科目:高中化学 来源: 题型:
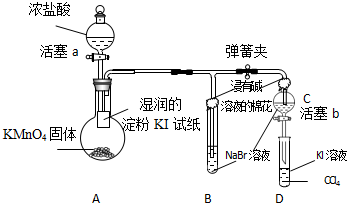
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、食醋用氢氧化钠溶液滴定开始时,溶液的pH通常变化缓慢,当接近完全反应时(即滴定终点),pH出现突变,称为滴定突跃 |
| B、当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据 |
| C、油墨是由多种色素按一定比例混合而成的,某同学欲用纸层析的方法将其主要色素分离开来,可选用的展开剂的物质是丙酮和盐酸 |
| D、提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)均应过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4LH2O含有的分子数为 NA |
| B、常温常压下,1.06g Na2CO3含有Na+离子个数为0.02 NA |
| C、含有阿伏德罗常数个微粒的物质就是1摩尔 |
| D、物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
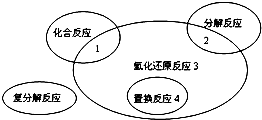
| A、Fe+CuSO4=FeSO4+Cu | ||||
B、2KMnO4
| ||||
| C、4Fe(OH)2+O2+2H2O=4Fe(OH)3 | ||||
| D、2Na2O2+2CO2=2Na2CO3+O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com