
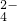 .请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).提出合理假设.
.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).提出合理假设.

科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3moL/LH2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 | / |
| 步骤2: 在A试管中滴加紫色石蕊试液 在A试管中滴加紫色石蕊试液 |
若先变红后退色,证明有ClO-,否则无 若先变红后退色,证明有ClO-,否则无 |
| 步骤3: 在B试管中滴加0.01mol?L-1KMnO4溶液 在B试管中滴加0.01mol?L-1KMnO4溶液 |
若紫红色退去,证明有SO32-,否则无 若紫红色退去,证明有SO32-,否则无 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
2- |
2- 3 |
2- 3 |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol/L H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 | ----- |
| 步骤2: | |
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol?L-1H2SO4溶液至溶液呈酸性,然后将所得溶液分置于A、B试管中. | / |
| 步骤2: |
|
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com