
����Ŀ����ҵ������������У�SO2�ڽӴ����б�������ΪSO3����֪�÷�ӦΪ���ȷ�Ӧ���ֽ�2molSO2��1molO2����һ�ܱ�������ַ�Ӧ�ų�����98.3kJ����ʱ���SO2��ת����Ϊ50%���������Ȼ�ѧ����ʽ��ȷ����
A. 2SO2(g)��O2(g)![]() 2SO3(g) ��H����196.6 kJ/mol
2SO3(g) ��H����196.6 kJ/mol
B. 2SO2(g)��O2(g)![]() 2SO3(g) ��H����98.3 kJ/mol
2SO3(g) ��H����98.3 kJ/mol
C. SO2(g)��![]() O2(g)
O2(g)![]() SO3(g) ��H����98.3 kJ/mol
SO3(g) ��H����98.3 kJ/mol
D. SO2(g)��![]() O2(g)
O2(g)![]() SO3(g) ��H����196.6 kJ/mol
SO3(g) ��H����196.6 kJ/mol
���𰸡�A
��������
��2mol SO2��1mol O2����һ�ܱ������г�ַ�Ӧ�ų�����98.3kJ����ʱ���SO2��ת����Ϊ50%��˵����Ӧ�ǿ��淴Ӧ�����ܽ��г��ף�ʵ�ʷ�����Ӧ�Ķ�������Ϊ1mol��1mol��������ȫ����Ӧ����98.3kJ���Ȼ�ѧ����ʽΪ��2SO2��g��+O2��g��2SO3��g����H=-196.6 kJmol-1��SO2��g��+![]() O2��g��SO3��g����H=-98.3 kJmol-1��
O2��g��SO3��g����H=-98.3 kJmol-1��
A�ѡ���е��Ȼ�ѧ����ʽ������������A��ȷ��
B�ѡ���е��Ȼ�ѧ����ʽ�з�Ӧ�ȺͶ�Ӧ�����������ʵ��������ϣ���H����196.6 kJ/mol����B����
C��÷�Ӧ�Ƿ��ȷ�Ӧ����H����98.3 kJ/mol����C����
D�ѡ���е��Ȼ�ѧ����ʽ�з�Ӧ�ȺͶ�Ӧ�����������ʵ��������ϣ���H����98.3 kJ/mol����D����
��ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������(����)
A.��Ԫ�ع㷺��������Ȼ���У���Ȼ���ʹ�й�ʯ
B.������������Ϣ���ٴ���������ҪӦ��
C.�����¹���ȶ�������ǿ�ᷢ����Ӧ
D.����������������첣�������ʹ衢���ά
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������a��b��c�㷺�����ڶ�ֲ�����ڣ�����������������˵����ȷ���ǣ� ��
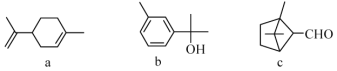
A. b��c��Ϊͬ���칹��
B. a��b��c����������̼ԭ�Ӳ����ܴ���ͬһƽ����
C. a��c����ʹ������Ȼ�̼��Һ��Ӧ��ɫ
D. b��c���������Ƶ�Cu(OH)2��Ӧ���ɺ�ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ӷ�Ӧ����ʽ��ȷ����
A. ������ SO2 ͨ�� NaClO ��Һ��SO2+H2O+2ClO��=SO32-+2HClO
B. ��������������Fe2O3+6H��=2Fe3��+3H2O
C. �ö������̺�Ũ���ᷴӦ��������MnO2+4HCl(Ũ)![]() Mn2��+2Cl�D+Cl2��+2H2O
Mn2��+2Cl�D+Cl2��+2H2O
D. ��Ũ�ȵ� NaHSO4 �� Ba(OH)2 �������Һ�����ԣ�Ba2��+2OH�D+SO42�D+2H��=BaSO4��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ҹ����Ԫ�أ����۵���ߵĽ������㷺�������Ƶ��ݵĵ�˿����������ʹ������������
��1��T��ʱ��WO3 �����µ��IJ���Ӧ���� W��ÿһ����Ӧ���ʱ��ƽ�ⳣ�����£�
WO3(s)+0.1H2(g)![]() WO2.9(s)+0.1H2O(g) ��H1 K1
WO2.9(s)+0.1H2O(g) ��H1 K1
WO2.9(s)+0.18H2(g)![]() WO2.72(s)+0.18H2O(g) ��H2 K2
WO2.72(s)+0.18H2O(g) ��H2 K2
WO2.72(s)+0.72H2(g)![]() WO2(s)+0.72H2O(g) ��H3 K3
WO2(s)+0.72H2O(g) ��H3 K3
WO2(s)+2H2(g)![]() W(s)+2H2O(g) ��H4 K4
W(s)+2H2O(g) ��H4 K4
����¶��£�WO3(s)+3H2(g)![]() W(s)+3H2O(g) K=_____��
W(s)+3H2O(g) K=_____��
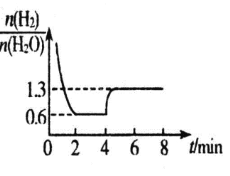
��2��T1��ʱ���� 4molH2 ������ WO3 ���� 2 L �ܱ������У�������Ӧ��O3(s)+3H2(g)![]() W(s)+3H2O(g)
W(s)+3H2O(g)
��������������ʵ���֮����ʱ��仯�Ĺ�ϵ��ͼ��ʾ��
������ѡ������˵����Ӧ�Ѿ��ﵽƽ�����_____��������ĸ��
a����Ӧ������(H2)=��(H2O)
b��ÿ���� 3molH-H ����ͬʱ���� 3molO-H ��
c����Ӧ�Ȳ���
d�����������ܶȲ��ٸı� e����ϵ��ѹǿ���ٸı�
�ڷ�Ӧ�� 2min ʱ�ﵽƽ�⣬��ʱ H2 ��ƽ��ת���� a=_____%��
������ 4 min ʱ���߲�ά���¶�Ϊ T2�����仯��ͼ��ʾ����÷�Ӧ����H_____0������ 8min ʱ��С �����ݻ�����n(H2)/n(H2O)________1.3��(����>���� <������=��)
��3�����õ�ⷨ���ԴӺϽ�̼����(WC)�����л�����Ԫ��(�Ͻ����١�̼��Ϊ���ʣ������ʱ���ú� ��̼�������������������������������ҺΪ���Һ�������������ᣨH2WO4�����ų� CO2���������ĵ� ����ӦʽΪ__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڽ�����˵����ȷ���ǣ�������
A.����������������ԭ��Ӧ�г�����ԭ��
B.�����ڼ��������¶�����������Ӧ
C.����������ͭ����������Ӧ������ͭ
D.��˿����������ȼ�������Ȼ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ�����ӵ�������ֵ������˵������ȷ����( )
A. ��״���£�2.24L ���Ȼ�̼���еķ�����ĿΪ 0.1NA
B. 25��ʱ��0.1 mol��L-1Na2S��Һ�к���Na+����ĿΪ0.2NA
C. 64g��SO2��������O2��ַ�Ӧ��ɵõ�NA��SO3����
D. 2.3gNa��O2��ȫ��Ӧ����3.6g����ʱʧȥ�ĵ�����Ϊ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��µ�2 L���ܱ������У�����3 mol A��1 mol B���������·�Ӧ��3A(g)��B(g)![]() 2C(g)��3D(s)��5 min�ﵽƽ��ʱ��n(B):n(C) =1:3��
2C(g)��3D(s)��5 min�ﵽƽ��ʱ��n(B):n(C) =1:3��
��1��0��5 min����B��ʾ��ƽ����Ӧ����Ϊ_______���ﵽƽ��ʱ��A��ת����Ϊ_______��
��2���ﵽƽ��ʱ����������ѹǿ�뷴Ӧǰ����������ѹǿ֮��_________��
��3��ά���������¶Ȳ��䣬����С�������������ƽ�⽫��_____(������ƶ����������ƶ������ƶ���)��
��4���ﵽƽ����������¶Ȳ��䣬��C�������з����һ���֣���ѧƽ�ⳣ��____(����������������С������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������в���ȷ����
A. 0.1mo1��L-1NH4HS��Һ����:c(NH4+)<c(HS-)+c(S2-)+c(H2S)
B. 25��ʱ����a mo1��L-1�İ�ˮ��0.01 mo1��L-1������������Ϻ�c(NH4+)=c(Cl-)����NH3��H2O�ĵ��볣��Ϊ![]()
C. ��Ũ�ȵ�HCN��NaCN�����Һ����:2c(Na+)=c(CN-)+c(HCN)
D. ��pH��HA��HB��Һ���ֱ���һ��Ũ�ȵ�����������Һ��ȫ�кͣ�HA���ĵ�����������Һ����࣬���֤������HA<HB
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com