


| 1 |
| 2 |
| m |
| V |
| 1 |
| 2 |
 ,
, ;
;| 1 |
| 2 |
| 2 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| V |
| ||
| V |
| ||
(2
|
| ||
(2
|


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 编号 | 改变的条件 | 生成NH3的速率 |
| ① | 升高温度 | |
| ② | 增大N2的浓度 | |
| ③ | 使用催化剂 | |
| ④ | 压缩体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 H++2e-═H2↑ |
| B、O2+2H2O+4e-═4OH- |
| C、Fe-2e-═Fe2+ |
| D、4 OH--4e-═2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从左到右,原子半径逐渐减小 |
| B、从左到右,元素单质的氧化性减弱,还原性增强 |
| C、从左到右,元素最高正将数从+1递增到+7,负价由-4递变到-1(O、F除外) |
| D、从左到右,元素最高价氧化物对应水化物碱性减弱,酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
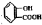 )、丙烯、乙烯为原料合成一种长效缓释阿司匹林片的路线如下:
)、丙烯、乙烯为原料合成一种长效缓释阿司匹林片的路线如下:
| Cl |


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com