
| A. | 正盐 | B. | 碱 | C. | 钠盐 | D. | 碳酸盐 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
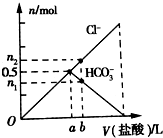 向Na2CO3溶液中逐滴滴加1mol•L-1盐酸,测得溶液中Cl-、HCO3-的物质的量随加入盐酸体积的关系如图所示,其中n2:n1=3:2,则下列说法不正确的是( )
向Na2CO3溶液中逐滴滴加1mol•L-1盐酸,测得溶液中Cl-、HCO3-的物质的量随加入盐酸体积的关系如图所示,其中n2:n1=3:2,则下列说法不正确的是( )| A. | 0a段反应的离子方程式为:CO32-+H+=HCO3- | |
| B. | 原Na2CO3溶液中含有0.5mol Na2CO3 | |
| C. | b点时生成的CO2的物质的量为0.1 mol | |
| D. | b点时HCO3-物质的量为0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食品袋中常放有硅胶和铁粉,都能起到干燥的作用 | |
| B. | 大力实施矿物燃料脱硫脱硝技术,能减少硫、氮氧化物的排放 | |
| C. | 明矾净水时发生了化学及物理变化,能起到净水作用,而没有杀菌、消毒的作用 | |
| D. | 某新型航天服材料主要成分是由碳化硅、陶瓷和碳纤维复合而成,它是一种新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学事实 | 类推结论 | |
| A | 常温下,pH=3的盐酸稀释1000倍后pH=6 | 常温下,pH=6的盐酸稀释1 000倍后pH=9 |
| B | 电解熔融MgCl2可制取金属镁 | 电解熔融AlCl3也可制取金属铝 |
| C | Na着火不能用干冰灭火 | K着火也不能用干冰灭火 |
| D | 将SO2通入BaCl2溶液中无沉淀生成 | 将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
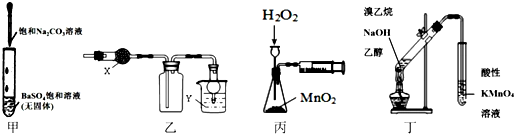
| A. | 甲可用于研究沉淀的转化,可比较出Ksp(BaSO4>Ksp(BaCO3) | |
| B. | 乙中X为无水CaCl2,Y为NaOH溶液时,该装置可用于SO2的收集 | |
| C. | 丙装置可定量测定H2O2的分解速率 | |
| D. | 丁可用于证明实验中生成了乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
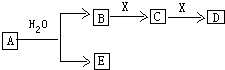
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com