
叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起。实验室测定叠氮化钠样品中NaN3的质量分数。实验步骤如下:
①称取约2.5000g叠氮化钠试样,配成250mL溶液。
②准确量取25.00mL溶液置于锥形瓶中,用滴定管加入50.00mL 0.1000mol·L-1
(NH4)2Ce(NO3)6(六硝酸铈铵),
[发生反应为:2(NH4)2Ce(NO3)6 +2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑](杂质不参与反应)。
③反应后将溶液稍稀释,然后向溶液中加入5mL浓硫酸,滴入2滴邻菲哕啉指示液,用0.0500mol·L-1(NH4)2Fe(SO4)2(硫酸亚铁铵)标准滴定溶液滴定过量的Ce4+至溶液由淡绿色变为黄红色(发生的反应为:Ce4++Fe2+= Ce3++Fe3+),消耗硫酸亚铁铵标准溶液24.00mL。
(1)步骤①配制叠氮化钠溶液时,除需用到烧杯、玻璃棒、量筒外,还用到的玻璃仪器有 、 。
(2)叠氮化钠受撞击时生成两种单质,反应的化学方程式为 。
(3)若其它读数正确,滴定到终点后,读取滴定管中 (NH4)2Fe(SO4)2标准溶液体积按图图示读取,将导致所测定样品中叠氮化钠质量分数 (选填:“偏大”、“偏小”或“不变”)。
(4)通过计算确定叠氮化钠试样中含NaN3的质量分数为多少(写出计算过程)。
(1)250mL容量瓶、胶头滴管(每空1分,共2分)
(2)2NaN3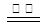 2Na + 3N2↑(2分)
2Na + 3N2↑(2分)
(3)偏小(2分)
(4)n[(NH4)2Ce(NO3)6]= 0.1000mol·L-1×50.00×10-3L=5.000×10-3mol
n[(NH4)2Fe(SO4)2]= 0.0500mol·L-1×24.00×10-3L=1.200×10-3mol
与NaN3反应的n[(NH4)2Ce(NO3)6]= 5.000×10-3mol-1.200×10-3mol
=3.800×10-3mol
ω=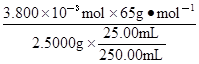 =0.9880 (共6分)
=0.9880 (共6分)
解析试题分析:配置一定物质的量浓度的溶液需用到250mL容量瓶、胶头滴管等仪器;(2)该物质只有两种元素,故只能生成氮气和金属钠;(3)该操作的原理是加入一定量的(足量)(NH4)2Ce(NO3) 6反应完全NaN3,再滴定剩余的(NH4)2Ce(NO3)6,根据差值计算出上述反应中反应物的量,故仰视滴定管导致标准液读数偏大,溶液体积增大,第一步反应(NH4)2Ce(NO3) 6量偏少,样品中叠氮化钠质量分数变小;
(4)总量n[(NH4)2Ce(NO3)6]= 0.1000mol·L-1×50.00×10-3L=5.000×10-3mol
参与第二步反应的量 n[(NH4)2Fe(SO4)2]= 0.0500mol·L-1×24.00×10-3L=1.200×10-3mol
与NaN3反应的n[(NH4)2Ce(NO3)6]= 5.000×10-3mol-1.200×10-3mol
=3.800×10-3mol
ω=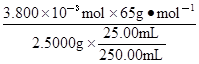 =0.9880
=0.9880
考点:考查定量测定计算与分析有关问题。


科目:高中化学 来源: 题型:实验题
.[实验化学]
苯亚甲基苯乙酮俗称查尔酮,淡黄色棱状晶体,熔点58℃,沸点208℃(3.3kPa)易溶于醚、氯仿和苯,微溶于醇。制备原理如下: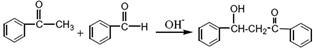
 (查尔酮)
(查尔酮)
(1)制备过程中,需在搅拌下滴加苯甲醛,并控制滴加速度使反应温度维持在25~30℃,说明该反应是 (填放热或吸热)反应。如温度过高时,则可以采取 措施。
(2)产品结晶前,可以加入几粒成品的查尔酮,其作用是 。
(3)结晶完全后,需抽滤收集产物。抽滤装置所包含的仪器除
减压系统外还有 、 (填仪器名称)。
(4)获得的深色粗产品加入活性炭,以95%乙醇重结晶。加入活性炭的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(16分)某化学兴趣小组在进行钠在空气中燃烧的实验,请写出钠在氧气中燃烧的化学方程式: 。实验后,同学们发现除了得到黄色物质外,产物中还有黑色物质。兴趣小组的同学对产生的黑色固体物质进行实验探究。
查阅资料:
工业上采用铁环作阴极电解得到金属钠。实验室中金属钠的标签主要内容如下: 
提出猜想:
猜想1:钠附着煤油,煤油的不完全燃烧可以生成碳单质;猜想2: 与钠反应也可以生成碳单质;
猜想3: ; 猜想4:……
设计实验方案,验证猜想:
| 实验目的 | 实验步骤 | 实验现象 | 结论 |
| 验证猜想1 | 将一小块钠从煤油中直接取出加热燃烧 取出一小块切去表皮并擦干净煤油的钠加热燃烧 | | 黑色物质中含 有碳单质 |
| 验证猜想3 | | | 黑色物质中 含有铁元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
[实验化学]
磷酸铁(FePO4·2H2O,难溶于水的米白色固体)可用于生成药物、食品添加剂和锂离子电池的正极材料,实验室可通过下列实验制备磷酸铁。
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤,反应加热的目的是 。
(2)向滤液中加入一定量H2O2氧化Fe2+。为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式如下:
①在向滴定管注入K2Cr2O7标准溶液前,滴定管需要检漏、 和 。
②若滴定xmL滤液中的Fe2+,消耗amol·L—1 K2Cr2O7标准溶液bmL,则滤液中
c(Fe2+)= mol·L—1
③为使滤液中的Fe2+完全被H2O2氧化,下列实验条件控制正确的是 (填序号)。
| A.加入适当过量的H2O2溶液 | B.缓慢滴加H2O2溶液并搅拌 |
| C.加热,使反应在较高温度下进行 | D.用氨水调节pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(20分)某研究性学习小组在实验室中配制0.20mol·L-1的盐酸标准溶液,然后用其滴定某未知浓度的氢氧化钠溶液。
⑴配制待测液:将1.7 g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200 mL溶液,所需的主要玻璃仪器除烧杯,200 mL容量瓶,量筒,还有 ﹑ 。
⑵滴定:
①盛装0.20mol·L-1盐酸标准液应该用 式滴定管,
②滴定时,先向锥型瓶中加酚酞作为指示剂;再逐滴滴定,观察到 时为滴定终点。
③有关数据记录如下:
| 滴定序号 | 待测液体体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 起始读数 滴定前 | 终点读数 | ||
| 1 | 20.00 | 0.50 | 20.40 |
| 2 | 20.00 | 6.00 | 26.10 |
| 3 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
固态化合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用下图装置(夹持装置略)对其进行探究实验。
(1)仪器B的名称是________。
(2)实验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为________;Ⅳ中发生反应的化学方程式为________;V中的试剂为________。
(3)乙组同学进行同样实验,但装置连接顺序为ⅠⅢⅣⅡVⅥ,此时Ⅱ中现象为________,原因是________。
(4)经上述反应,2.5 g化合物A理论上可制得0.56 L(标准状况)M,则A的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I反应产物的定性探究
按下图装置(固定装置已略去)进行实验
(1)A中反应的化学方程式为:
(2)F烧杯中的溶液通常是 。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为 。
实验Ⅱ 反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
资料1:
资料2:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。
仅由上述资料可得出的正确结论是 。
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15 mol·L-1
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol·L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为ag,则硫酸铜的产率为 。 (已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与硫酸反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定,以下实验过程不完整,请补充完整。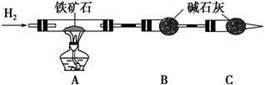
(1)按上图组装仪器,并______________________________________________;
(2)将8.0 g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
(3)从左端导气管口处不断地缓缓通入H2,____________________________,
点燃A处酒精灯;
(4)充分反应后,撤掉酒精灯,________________________________________;
(5)测得反应后装置B增重2.25 g,则铁矿石中氧的百分含量为________。
Ⅱ.铁矿石中含铁量的测定,流程如下。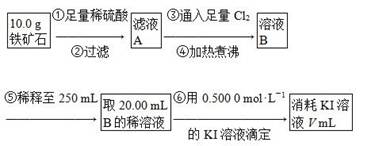
(1)步骤④中煮沸的作用是___________________________________________。
(2)步骤⑤中用到的玻璃仪器有烧杯、胶头滴管、250 mL容量瓶、________。
(3)下列有关步骤⑥的操作中说法正确的是________。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.锥形瓶不需要用待测液润洗
c.滴定过程中可利用淀粉溶液作指示剂
d.滴定过程中,眼睛注视滴定管中液面变化
e.滴定结束后,30 s内溶液不恢复原来的颜色,再读数
f.滴定结束后,滴定管尖嘴部分有气泡,则测定结果偏大
(4)若滴定过程中消耗0.500 0 mol·L-1 KI溶液20.00 mL,则铁矿石中铁的百分含量为________。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com