
| 1.1 |
| C(HCO3-).C(H+) |
| C(H2CO3) |
| Ksp(BaCO3) |
| C(Ba2+) |
| Ksp(BaSO4) |
| C(Ba2+) |
| C(HCO3-).C(H+) |
| C(H2CO3) |
| 1×10-5.6×1×10-5.6 |
| 1.5×10-5 |
| Ksp(BaCO3) |
| C(Ba2+) |
| Ksp(BaSO4) |
| C(Ba2+) |
| 1.1×10-10 |
| Ksp(BaCO3) |
| c(Ba2+) |
| 5.1×10-9 |
| 1×10-5 |


科目:高中化学 来源: 题型:阅读理解
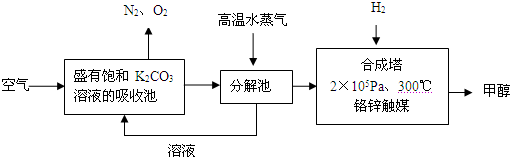
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:河北省冀州中学2011-2012学年高一下学期期中考试化学理科试题(B)卷科 题型:022
已知1 mol SO2(g)完全转化为1 mol SO3(g)放热99 kJ.2SO2(g)+O2(g)![]() 2SO3(g) ΔH=a kJ·mol-1,反应过程的能量变化如图所示.请回答:
2SO3(g) ΔH=a kJ·mol-1,反应过程的能量变化如图所示.请回答:

(1)图中ΔH=________.
(2)该反应常用V2O5作催化剂,加入V2O5会使图中Ea________ΔH________(两空均填“升高”.“降低”或“不变”).
(3)已知单质硫的燃烧热为296kJ·mol-1,写出反应的热化学方程式:________,常温常压下,由单质硫和氧气经两步反应,生成3 mol SO3(g),放出的总热量为________.
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省德州市重点中学高二10月月考化学试卷(带解析) 题型:填空题
每空2分,共12分)化学反应可为人类提供能量
(Ⅰ)家用液化气的主要成分之一是丁烷(C4H10),常温常压下,当5.8 kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为2.9×105kJ,试写出丁烷燃烧的热化学方程式:____________________________________________,已知1mol液态水气化时需要吸收44 kJ的热量,则反应: 的ΔH为____________________。
的ΔH为____________________。
(Ⅱ)铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据上述情况判断:
(1)蓄电池的负极是______,其电极反应式为______________________________。
(2)蓄电池的正极电极反应式为_________________________________。
(3)蓄电池工作时,其中电解质溶液的pH______(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014届山东省德州市高二10月月考化学试卷(解析版) 题型:填空题
每空2分,共12分)化学反应可为人类提供能量
(Ⅰ)家用液化气的主要成分之一是丁烷(C4H10),常温常压下,当5.8 kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为2.9×105kJ,试写出丁烷燃烧的热化学方程式:____________________________________________,已知1mol液态水气化时需要吸收44 kJ的热量,则反应:
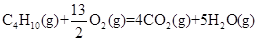 的ΔH为____________________。
的ΔH为____________________。
(Ⅱ)铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据上述情况判断:
(1)蓄电池的负极是______,其电极反应式为______________________________。
(2)蓄电池的正极电极反应式为_________________________________。
(3)蓄电池工作时,其中电解质溶液的pH______(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种短周期主族元素,其核电荷数依次增大,已知元素A和C可形成两种常温下均为液体的化合物,B原子最外层电子数是最内层电子数的两倍,A与D、C与F分别处于同一主族且A、D质子数之和是C、F质子数之和的一半,18gE与足量盐酸反应生成标准状况下的H222.4L。
请按要求回答:
(1)由A、C、D三种元素形成的化合物X中含有的化学键类型为_______。
(2)A、D、F三种元素形成的化合物Y溶液中的微粒浓度之间存在如下关系(请填写下式中的空白,每空只填一种微粒浓度的符号)。
c(H+)+_______:c(OH―)+ _______。
(3)E、F构成的化合物能与水反应,写出化学方程式_______。
(4)①写出单质D与乙醇反应的化学方程式_______。
②A、B、C三种元素可以形成最简式为A4B2C的有机物,该有机物与足量X水溶液反应得到的两种产物中含有相同数目的B原子。写出该反应的化学方程式_____。
(5)A和B组成的化合物M,每个分子中含有18个电子,常温常压下,0.5molM完全燃烧放出780kJ的热量,请写出表示M完全燃烧的热化学方程式____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com