
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
分析 在溶液中的反应,若反应产物与反应物的量无关时,只发生一个化学反应,反应物相同,生成物也相同,则能用同一离子方程式表示,若反应产物与反应物的量有关时,不能用同一个离子方程式表示,以此来解答.
解答 解:①碘离子还原性大于亚铁离子,氯气不足时碘离子优先反应,氯气过量时亚铁离子、碘离子都被氧化,所以改变反应物用量,不能用同一个离子方程式表示,故①正确;
②Na2SO3溶液与稀盐酸反应,盐酸量少,反应生成亚硫酸氢钠,离子反应为SO32-+H+═HSO3-,而盐酸量多时,反应生成二氧化硫和水,离子反应为SO32-+2H+═H2O+SO2↑,不能用同一个离子方程式来表示,故②正确;
③Si与烧碱溶液反应无论以何种量混合,二者反应生成硅酸钠和水,SiO2+2OH-═SiO32-+H2O,可以用同一离子方程式表示,故③错误;
④Fe与稀硝酸反应,Fe不过量生成Fe3+,4H++NO3-+Fe═Fe3++NO↑+2H2O,Fe过量生成Fe2+,8H++2NO3-+3Fe═3Fe2++2NO↑+4H2O,不能用同一个离子方程式来表示,故④正确;
根据分析可知,改变反应物用量,不能用同一个离子方程式表示的是①②④,
故选B.
点评 本题考查离子方程式的书写,为高考常见题型,侧重于与量有关的离子的方程式的书写和判断,注意把握物质的性质,为解答该题的关键,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究小组将纯净的SO2气体通入0.1mol•L?1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2,该小组进行了如下假设:
某研究小组将纯净的SO2气体通入0.1mol•L?1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2,该小组进行了如下假设:| 实验步骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 假设一成立 | |
| 实验2:在盛有不含O2的25ml0.1mol/LBa(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 |
| 实验步骤 | 实验现象 | 结论 |
| 假设二成立 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Ca2+、Fe2+、NO3-、CO32- | |
| B. | $\frac{{K}_{W}}{c(O{H}^{-})}$=0.1 mol•L-1的溶液中:Na+、NH4+、Cl-、NO3- | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、SCN-、SO42-、Cl- | |
| D. | 由水电离的c(H+)=1×10-14 mol•L-1的溶液中:Na+、AlO2-、HCO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOC2H5+H2O | |
| B. | H-C≡C-H+HCl$\stackrel{催化剂}{→}$H2C=CHCl | |
| C. | 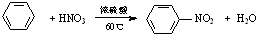 | |
| D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两溶液中c(OH-):①>② | B. | 两溶液中阳离子数目:②是①的2倍 | ||
| C. | ①溶液中:c(CO32-)<c(H2CO3) | D. | ②溶液中:c(HCO3-)<c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中可大量共存:Mg2+、HCO32-、SO42-、OH- | |
| B. | 新制的饱和氯水中可大量共存:Na+、CO32-、SO32-、 | |
| C. | 醋酸除水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| D. | 用惰性电极电解熔融氯化钠:2Cl-+2Na+$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Na2S4O6、H2O、Na2S2O3、Au2O、NaOH | |
| B. | Na2S2O3、H2O、Na2S4O6、Au2O、NaOH | |
| C. | Na2S2O3、NaOH、Na2S4O6、Au2O、H2O | |
| D. | 当1mol Au2O3完全反应时,转移电子的物质的量为8mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com