
| A. | b>2a | B. | a=2b | C. | b=2a | D. | b<2a |
分析 氢氧化钠溶液浓度越大密度越大,令质量分数为W的NaOH溶液的密度为xg/ml,质量分数为2W的NaOH溶液的密度为yg/ml,根据c=$\frac{1000ρω}{M}$表示质量分数为W、2W的NaOH溶液的物质的量浓度,据此结合密度x<y判断.
解答 解:令质量分数为W的NaOH溶液的密度为xg/ml,质量分数为2W的NaOH溶液的密度为yg/ml,则:
质量分数为W的NaOH溶液的物质的量浓度为a=$\frac{1000×x×W}{40}$mol/L;
质量分数为2W的NaOH溶液的物质的量浓度为b=$\frac{1000×y×2W}{40}$mol/L,
氢氧化钠溶液浓度越大,密度越大,所以x<y,故b>2a.
故选A.
点评 本题考查物质的量浓度计算等,难度中等,理解物质的量浓度定义,注意物质的量浓度与质量分数之间关系.


科目:高中化学 来源: 题型:选择题
| A. | 强电解质的导电能力可能弱于弱电解质 | |
| B. | 二氧化碳的水溶液能够导电,因此二氧化碳是电解质 | |
| C. | 金属氧化物都是碱性氧化物 | |
| D. | 胶体和溶液的本质区别是丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
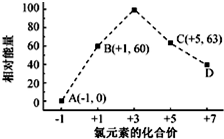 元素周期表中第 VIIA族元素的单质及其化合物的用途广泛.
元素周期表中第 VIIA族元素的单质及其化合物的用途广泛.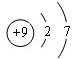 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4 g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 在标准状况下,22.4 LCH4与18 g H2O所含有的电子数均为10NA | |
| C. | 22.4 L CO气体与l molN2所含的电子数相等 | |
| D. | 1 mol HCl气体中的分子数与2L0.5 mo1/L盐酸中溶质分子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 由N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ•mol-1热化学方程式可知,当反应中转移6NA电子 时,反应放出的热小于92.4 kJ | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 在101 kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com