
【题目】5.00g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示:
请回答下列问题:

(1)试确定110℃时固体物质的化学式___________ ;
(2)取200℃所得样品,加热至280℃,该反应的化学方程式为:__________________________________
(3)将280℃所得产物在570℃下灼烧得到的主要产物是1.60g黑色粉末和一种氧化性气体,黑色粉末的化学式为______________ 。
【答案】CuSO4·3H2O CuSO4·H2O ![]() CuSO4 + H2O CuO
CuSO4 + H2O CuO
【解析】
由图分析可知,CuSO45H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,到258℃时才会继续分解;根据相应的化学方程式即可确定此时固体物质的化学式。
(1)设110℃时固体物质的化学式是CuSO4(5-n)H2O;
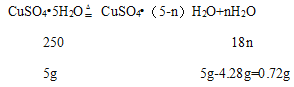
![]() ,解得n=2,
,解得n=2,
110℃时固体物质的化学式是CuSO4·3H2O;
(2)设200℃时固体物质的化学式是CuSO4(5-m)H2O;
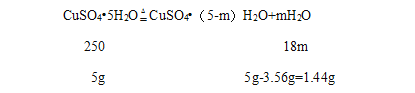
![]() ,解得m=4,
,解得m=4,
200℃时该固体物质的化学式为CuSO4H2O,
设280℃时固体物质的化学式是CuSO4(5-a)H2O;
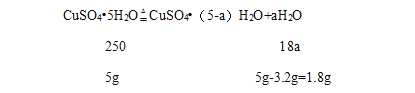
![]() ,解得a=5,
,解得a=5,
280℃时固体物质的化学式是CuSO4;
200℃所得样品,加热至280℃,反应的化学方程式为CuSO4·H2O ![]() CuSO4 + H2O;
CuSO4 + H2O;
(3)CuSO4在570℃下灼烧得到氧化性气体是三氧化硫,根据铜元素守恒,黑色粉末含铜元素![]() ,含有氧元素
,含有氧元素![]() 0.02mol,所以该黑色粉末的化学式是CuO。
0.02mol,所以该黑色粉末的化学式是CuO。


 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:
【题目】a、b、c、d、e五种短周期元素的原子半径和最外层电子数之间的关系如图所示。下列说法正确的是( )

A. 简单离子半径:b>e
B. 常温常压下,a与c形成的化合物可能呈固态
C. 单质沸点:c<d
D. d与e不能存在于同一离子化合物中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图装置可处理乙醛废水,乙醛在阴、阳极分别转化为乙醇和乙酸。下列说法正确的是( )
A.b电极为正极
B.电解过程中,阴极区Na2SO4的物质的量增大
C.阳极电极反应式为CH3CHO-2e-+H2O===CH3COOH+2H+
D.电解过程中,阴、阳极还分别产生少量的O2和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对某溶液中部分离子的定性检测流程如下。相关分析正确的是

A. 步骤①所加试剂可以是浓NaOH溶液
B. 可以用湿润的蓝色石蕊试纸检验生成的无色气体
C. 红褐色沉淀与HI反应的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O
D. 步骤②的反应为:Al3++3HCO3-=Al(OH)3↓+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 用惰性电极电解MgCl2溶液:2Cl- + 2H2O![]() 2OH-+ H2↑+ Cl2↑
2OH-+ H2↑+ Cl2↑
B. 用银氨溶液检验乙醛中的醛基:CH3CHO+![]() +2OH-
+2OH-![]() CH3COO-+
CH3COO-+![]() +3NH3+2Ag↓+H2O
+3NH3+2Ag↓+H2O
C. 邻羟基苯甲酸中加入足量NaHCO3溶液:

D. 向含NaOH的Cu(OH)2悬浊液中加入乙醛溶液并加热: CH3CHO +2Cu(OH)2+ OH-![]() CH3COO-+ Cu2O↓+3H2O
CH3COO-+ Cu2O↓+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. BaSO3与稀HNO3反应:BaSO3+2H+=Ba2++SO2↑+H2O
B. 用纯碱溶液溶解苯酚:CO32-+2C6H5OH=2C6H5O-+CO2↑+H2O
C. 等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合:2Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Fe(OH)3↓
D. 用石墨作电极电解MgCl2溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为实现随处可上网,中国发射了“中星16号”卫星。NH4ClO4是火箭的固体燃料,发生反应为2NH4ClO4 ![]() N2↑+Cl2↑+2O2↑+4H2O,NA代表阿伏加德罗常数,下列说法正确的是
N2↑+Cl2↑+2O2↑+4H2O,NA代表阿伏加德罗常数,下列说法正确的是
A. 1mol NH4ClO4溶于水含NH4+和ClO4-离子数均为NA
B. 反应中还原产物分子数与氧化产物分子总数之比为1:3
C. 产生6.4g O2反应转移的电子总数为0.8NA
D. 0.5mol NH4ClO4分解产生的气体体积为44.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T℃时,向V L的密闭容器中充入一定量的A和B,发生的反应为A(g)+B(g)![]() C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是( )
C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是( )
时间 | 0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min |
A的物质的量浓度(mol·L-1) | 3.5 | 2.3 | 2.0 | 2.0 | 2.8 | 3.0 | 3.0 |
B的物质的量浓度(mol·L-1) | 2.5 | 1.3 | 1.0 | 1.0 | 1.8 | 2.0 | 2.0 |
D的物质的量浓度(mol·L-1) | 0 | 2.4 | 3.0 | 3.0 | 1.4 | 1.0 | 1.0 |
A.前10 min的平均反应速率v(D)=0.3 mol·L-1·min-1
B.该反应的平衡常数表达式为K=![]()
C.若达到平衡时保持温度不变,压缩容器体积,平衡不移动
D.反应至15 min时,改变的条件可以是降低温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com