
【题目】已知某工业废水中含有大量FeSO4,较多的Cu2+,极少量的Na+以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。

(1)步骤1的主要操作名称是_____,该操作用到的玻璃仪器是_____
A.烧杯 B.漏斗 C.酒精灯 D.玻璃棒
(2)固体X是_____(填化学式),溶液Y是_____(填化学式)
(3)步骤2中发生反应的离子方程式为 _____ 。
(4)将回收的铜和一定浓度的稀硫酸混合后在加热的情况下通入氧气,发生反应:2Cu+2H2SO4+O2![]() 2CuSO4+2H2O中,氧化剂是________,还原剂是_______。用单线桥法标出上述反应的电子得失:______________________。
2CuSO4+2H2O中,氧化剂是________,还原剂是_______。用单线桥法标出上述反应的电子得失:______________________。
(5)步骤4中涉及的操作是:蒸发浓缩、___________、过滤、洗涤、干燥。
【答案】过滤 ABD Fe H2SO4 Fe+Cu2+===Fe2++Cu O2 Cu 2Cu+2H2SO4+O2![]() 2CuSO4+2H2O 冷却结晶
2CuSO4+2H2O 冷却结晶
【解析】
工业废水中含有大量FeSO4,较多的Cu2+,少量的Na+以及部分污泥,首先通过步骤1进行过滤除去污泥,在步骤2中加入过量的Fe,发生反应为Fe+Cu2+═Cu+2Fe2+,过量的Fe用稀硫酸除去,发生反应为Fe+H2SO4═FeSO4+H2↑,最后所得滤液经蒸发浓缩、冷却结晶、过滤可得到FeSO47H2O晶体。
(1)步骤1、步骤2、步骤3都为过滤操作,需要的玻璃仪器有烧杯、玻璃棒、普通漏斗,故答案为:ABD;
(2)步骤2中加入过量的Fe,发生反应Fe+Cu2+═Cu+2Fe2+,步骤3中过量的Fe用稀硫酸除去,发生反应为Fe+H2SO4═FeSO4+H2↑,固体X是Fe,溶液Y是稀硫酸,故答案为:Fe;稀硫酸;
(3)步骤2中加入过量的Fe,发生反应Fe+Cu2+═Cu+2Fe2+,故答案为:Fe+Cu2+═Cu+2Fe2+;
(4)2Cu+2H2SO4+O2![]() 2CuSO4+2H2O反应中,O2中O元素化合价降低,做氧化剂,Cu单质中Cu元素化合价升高,做氧化剂,故答案为:O2;铜;单线桥略;
2CuSO4+2H2O反应中,O2中O元素化合价降低,做氧化剂,Cu单质中Cu元素化合价升高,做氧化剂,故答案为:O2;铜;单线桥略;
(5)最后所得滤液经蒸发浓缩、冷却结晶、过滤可得到FeSO47H2O晶体,故答案为:冷却结晶。


科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.2 mol·L-1H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是

A. 当V( NaOH )= 20mL时,pH<7
B. 当V(NaOH)= 20mL时,溶液中离子浓度大小关系为c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+)
C. 当V(NaOH)= 10mL时,有c(Na+)=2[c(HA-)+c(A2-)+c(H2A)]
D. 当V(NaOH)= 30mL时,2c(H+)+3c(H2A)+c(HA-)= 2c(OH-)+c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、O、S、H都是中学化学中常见的元素。按要求完成下列填空。
(1)0.5 mol CH4的质量为____________;标准状况下,4.48 L NH3所含分子数为___________。
(2)等物质的量的CH4、NH3和N2三种气体,所含原子数之比为__________,等质量的CH4和N2物质的量之比为__________。
(3)含有1.806×1024个电子的OH- 的物质的量为____;0.5 mol H2O分子中所含电子数与_____个NH4+中所含电子数相等。
(4)在标准状况下,由SO2和CO2组成的混合气体为8.96 L,质量为24 g,该混合气体的平均摩尔质量是__________,混合气体中CO2的体积分数是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期金属元素甲~戊在周期表中的相对位置如表所示,下面判断不正确的是( )
甲 | 乙 | |
丙 | 丁 | 戊 |
A.原子半径:丙>丁>戊
B.最外层电子数:甲>乙
C.金属性:甲<丙
D.氢氧化物碱性:丙>丁>戊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室为探究铁与浓硫酸(足量)的反应,并验证SO2的性质,设计如图所示装置进行实验,下列说法不正确的是( )
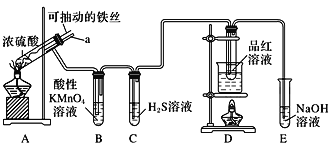
A.装置B中酸性KMnO4溶液逐渐褪色,体现了二氧化硫的还原性 |
B.实验结束后可向装置A的溶液中滴加KSCN溶液以检验生成的Fe3+ |
C.装置D中品红溶液褪色可以验证SO2的漂白性 |
D.实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法正确的是( )
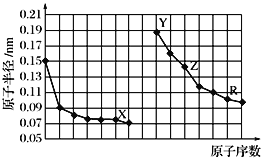
A. Z和R所形成的化合物,不能通过溶液中复分解反应而制得
B. 简单离子的半径关系是:R>Y>Z>X
C. X和Y所形成的一种化合物,可用于自来水消毒
D. 工业上获得单质Z的方法,一般是通过电解其熔融氯化物来实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有K+、Fe3+、NO3﹣ , 已知K+、Fe3+的个数分别为3a和a,则溶液中K+与NO3﹣的个数比为( )
A.1:4
B.1:2
C.3:4
D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的原子最外层只有一个电子,其原子与卤素原子结合时,所形成的化学键( )
A.一定是离子键
B.一定是共价键
C.可能是离子键也可能是共价键
D.以上说法都不正确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com