
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | 1×10-13 | 1×10-12 |
分析 (1)硫酸钠溶液是显中性的,cc(OH-)=10-7mol/L,钠离子浓度稀释10倍浓度会减少10倍;
(2)t2水的离子积常数为1×10-12,混合液呈中性,c(H+)=c(OH-)=10-6mol/L,c(Na+)=c(CH3COO-)=0.5bmol/L,然后结合醋酸的电离平衡常数表达式进行计算;
(3)Ag2O溶于氨水(用 NH3表示)生成银氨溶液[Ag(NH3)2+]的离子方程式为:Ag2O+H2O+4NH3?2Ag(NH3)2++2OH-,可以由所给的反应通过变形得来,反应热做相应的变化即可;当反应相加时,K相乘;反应相减时,K相除;反应乘以几,则K变为几次方;反应除以几,则K开几次方,据此分析.
解答 解:(1)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中钠离子浓度是1×10-3 mol/L.如果稀释10倍,则钠离子浓度是1×10-4 mol/L.但硫酸钠溶液是显中性的,所以c(Na+):c(OH-)=10-4:10-7=1000:1,故答案为:1000:1;
(2)t2水的离子积常数为1×10-12,混合液呈中性,c(H+)=c(OH-)=10-6mol/L,c(Na+)=c(CH3COO-)=0.5bmol/L,醋酸的电离平衡常数Ka=$\frac{[C{H}_{3}CO{O}^{-}][{H}^{+}]}{[C{H}_{3}COOH]}$=$\frac{0.5b×1{0}^{-6}}{0.5a-0.5b}$=$\frac{b×1{0}^{-6}}{a-b}$,
故答案为:$\frac{b×1{0}^{-6}}{a-b}$;
(3)已知反应:Ag+(aq)+2NH3(aq)?Ag(NH3)2+(aq)△H=a kJ?mol-1 ①
2Ag+(aq)+2OH-(aq)?Ag2O(s)+H2O(l)△H=b kJ?mol-1 ②
将反应①×2-②可得:Ag2O(s)+H2O(l)+4NH3(aq)?2Ag(NH3)2+(aq)+2OH-(aq) 故反应热△H=(2 a-b)kJ?mol-1,
由于Ag2O(s)+H2O(l)+4NH3(aq)?2Ag(NH3)2+(aq)+2OH-(aq)是由①×2-②得来,故此反应的K=$\frac{{c}^{2}}{d}$,
故答案为:Ag2O(s)+H2O(l)+4NH3(aq)?2Ag(NH3)2+(aq)+2OH-(aq)△H=(2 a-b)kJ?mol-1;$\frac{{c}^{2}}{d}$.
点评 本题考查了水的电离、弱电解质电离平衡、离子积常数的简单计算、热化学方程式的书写和盖斯定律的计算应用,应注意反应的变形所对应的K的变化,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
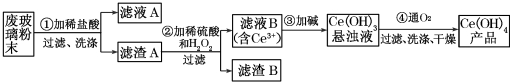
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
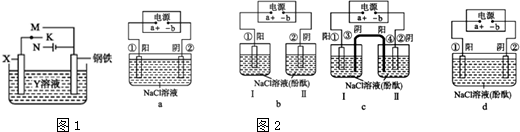
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱溶液显碱性:CO32-+2H2O?H2CO3+2OH- | |
| B. | 醋酸溶液显酸性:CH3COOH+H2O?CH3COO-+H3O+ | |
| C. | 向碘化亚铁溶液中通入足量的溴水:2 Br2+2Fe2++2I-═4Br-+2Fe3++I2 | |
| D. | 向碳酸氢钙溶液中滴加过量的烧碱溶液:HCO3-+Ca2++2OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 回收各种废弃塑料 | B. | 将用过的塑料袋立即焚烧 | ||
| C. | 使用可降解塑料 | D. | 用布购物袋替代一次性塑料购物袋 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B位于元素周期表中第二周期第ⅥA族 | |
| B. | 工业上可以用电解CE溶液的方法同时获得C、E单质 | |
| C. | C、D的最高价氧化物对应的水化物之间能发生化学反应 | |
| D. | 化合物AE与CE具有相同类型的化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | Z | R |
| W |
| A. | Z的氧化物与X单质不可能发生置换反应 | |
| B. | X、Z原子序数可能相差18 | |
| C. | Z可能是氯元素 | |
| D. | 五种元素的原子最外层电子数一定都大于2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Na2FeO4中Fe为+4价,具有强氧化性,能杀菌消毒 | |
| B. | Na2O2既是氧化剂又是还原剂 | |
| C. | Na2FeO4既是氧化产物又是还原产物 | |
| D. | 3mol Na2O2发生反应,有12mol电子转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com