
| A、Ca(ClO)2溶液中:c(Ca2+)>c(ClO-)>c(OH-)>c(H-) |
| B、等体积、等物质的量浓度的Na2SO3溶液与NaHSO3溶液混合:c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) |
| C、将0.2mol.L-1的某一元酸HA溶液和0.1mol.L-1的NaOH溶液等体积混合后溶液的pH大于7,则反应后的混合液:2c(OH-)+c(A-)=2c(H+)+c(HA) |
| D、某溶液中水电离出的c(OH-)=1×10-amol.L-1若a>7时,则pH该溶液的一定为14-a |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、溴单质与水的反应比氯单质与水的反应更剧烈 |
| B、碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强 |
| C、钾与水的反应比钠与水的反应更剧烈 |
| D、随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CO2的电子式:
| ||||||||||||
B、Cl-的结构示意图 | ||||||||||||
| C、甲烷的结构式 CH4 | ||||||||||||
D、质量数为37的氯原子
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
| A、在冰醋酸中这四种酸都没有完全电离 |
| B、在冰醋酸中高氯酸是这四种酸中最强的酸 |
| C、在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO42- |
| D、酸的强弱与其本身的结构和溶剂的性质有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 标出原电池的电极材料和电解质溶液,并写出负极的电极反应为
标出原电池的电极材料和电解质溶液,并写出负极的电极反应为| 原子 | N | S | O | Si |
| 半径r/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用蒸发结晶法除去KNO3中少量的NaCl |
| B、用加入NaOH(aq)并蒸馏的方法除去乙醛中少量的乙酸 |
| C、准确称取14.800g Ca(OH)2,配制100mL 2.0 mol/L的Ca(OH)2溶液 |
| D、在2mL10%的CuSO4(aq)中滴入3滴 2%的NaOH(aq),配制检验醛基的试剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 结构的有机物可被酸性高锰酸钾溶液氧化成二元醇,如:CH2=CH2
结构的有机物可被酸性高锰酸钾溶液氧化成二元醇,如:CH2=CH2| 酸性高锰酸钾溶液 |
 )为原料合成环状化合物F和高分子化合物E和G.
)为原料合成环状化合物F和高分子化合物E和G.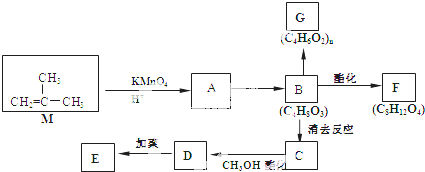
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com