
| A. | 油脂的氢化 | B. | 蛋白质的水解 | C. | 油脂的水解 | D. | 氨基酸形成二肽 |
科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器Ⅰ、Ⅱ中正反应速率相同 | |
| B. | 容器Ⅰ、Ⅲ中反应的平衡常数相同 | |
| C. | 容器Ⅰ中的气体颜色比容器Ⅱ中的气体颜色深 | |
| D. | 容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化率之和等于1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | d>b>c>a | B. | c>d>a>b | C. | d>a>b>c | D. | c>d>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 分离、提纯方法 |
| A | 提纯粗苯甲酸 | 重结晶 |
| B | 分离乙醇和丁醇 | 蒸馏 |
| C | 除去乙炔中的H2S气体 | 用CuSO4溶液洗气 |
| D | 除去苯中的苯酚 | 加入NaOH溶液后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
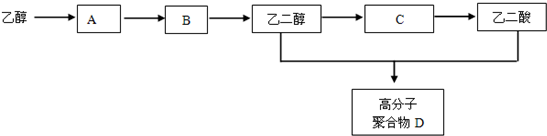

 +(2n-1)H2O 反应类型为聚合反应.
+(2n-1)H2O 反应类型为聚合反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com