
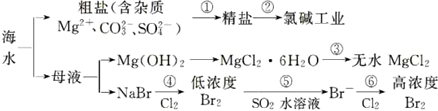
| A. | 过程①的提纯只有物理过程,过程②通过氧化还原反应可产生两种单质 | |
| B. | 在过程③中将MgCl2•6H2O真接灼烧即可制得纯净无水MgCl2 | |
| C. | 过程⑥所得的高浓度溴水只需分液即可获得液溴 | |
| D. | 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀间题 |
分析 海水蒸发溶剂得到粗盐和母液,粗盐通过精制得到精盐,电解饱和食盐水得到氯气、氢气和氢氧化钠;母液通入氯气氧化溴离子为溴单质,被二氧化硫吸收后发生氧化还原反应生成溴化氢,富集溴元素,通入氯气氧化溴化氢为溴单质得到高浓度的溴;
A.根据粗盐的提纯及电解饱和食盐水产物进行判断,过程①的提纯中过滤属于物理过程,但是除去镁离子、碳酸根离子、硫酸根离子属于化学过程;
B.因MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等,得不到无水MgCl2,根据镁离子水解显酸性进行分析;
C.溴易溶于水,应蒸馏分离;
D.根据反应⑤二氧化硫与溴单质的生成产物进行分析.
解答 解:A.过程①的提纯中过滤属于物理过程,但是除去镁离子、碳酸根离子、硫酸根离子属于化学过程;过程②电解饱和食盐水获得了氯气和氢气两种单质,故A错误;
B.因MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等,得不到无水MgCl2,若要由MgCl2•6H2O灼烧即可制得无水MgCl2,为防止Mg2+发生水解,应在HCl气氛中进行,故B错误;
C.溴易溶于水,应蒸馏分离,不能进行分液操作,故C错误;
D.因Br2+SO2 +2H2O=2HBr+H2SO4,反应后溶液呈酸性,能与金属容器反应,故D正确;
故选D.
点评 本题考查了海水资源综合利用,为高频考点,涉及了离子的除杂、离子水解、氧化还原反应、元素及其化合物的有关知识进行综合利用,提高了试题的综合性,本题难度中等.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| W | X | ||
| Y | Z |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏常用于分离提纯液态有机混合物 | |
| B. | 核磁共振氢谱通常用于分析有机物中氢的个数 | |
| C. | 对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 | |
| D. | 燃烧法是研究确定有机物元素组成的有效方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | +6、-2 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.130 | 0.102 | 0.110 | 0.143 | 0.160 | 0.186 |
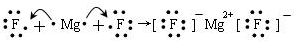 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
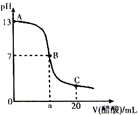 在20mL0.100mol•L-1NaOH溶液中逐滴加入0.200mol•L-1醋酸溶液,曲线如图所示,有关粒子浓度关系比较正确的是( )
在20mL0.100mol•L-1NaOH溶液中逐滴加入0.200mol•L-1醋酸溶液,曲线如图所示,有关粒子浓度关系比较正确的是( )| A. | A点到B点的变化过程中,离子浓度大小关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 在B点a>10,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+) | |
| C. | B点到C点的变化过程中,离子浓度大小关系:c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| D. | 在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com