
| A. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| B. | 向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | |
| C. | 向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| D. | FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 |
分析 A.盐酸具有还原性,能够被高锰酸钾氧化;
B.二氧化碳过量反应生成次氯酸和碳酸氢钙;
C.次氯酸根离子具有强的氧化性,能够氧化二氧化硫;
D.二价铁离子还原性强于溴离子,氯气先氧化二价铁离子再氧化溴离子.
解答 解:A.盐酸具有还原性,能够被高锰酸钾氧化,所以证明H2O2具有还原性不能用盐酸酸化高锰酸钾,故A错误;
B.向次氯酸钙溶液通入过量CO2,离子方程式:ClO-+CO2+H2O=HCO3-+HClO,故B错误;
C.向次氯酸钙溶液中通入少量SO2的离子反应为Ca2++2ClO-+H2O+SO2═CaSO4↓+H++Cl-+HClO,故C错误;
D.FeBr2溶液与等物质的量的Cl2反应,二价铁离子全部被氧化,溴离子部分被氧化,离子方程式:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2,故D正确;
故选:D.
点评 本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,并熟悉离子反应方程式的书写方法来解答,题目难度不大.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2AB(g)?A2(g)+B2(g)△H>0 | B. | A2(g)+3B2(g)?2AB3(g)△H<0 | ||
| C. | A(s)+B(g)?C(g)+D(g)△H>0 | D. | 2A(g)+B(g)?3C(g)+D(s)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
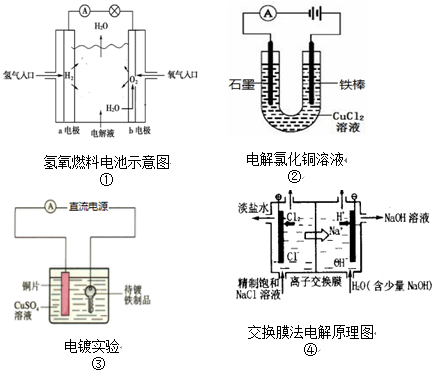
| A. | 装置①中,b极发生氧化反应 | |
| B. | 装置②中,铁棒上析出红色固体 | |
| C. | 装置③中,若电镀前两极金属的质量相等,电镀完成后二者质量差5.12g,则电镀时电路中的待镀铁制品应与电源负极相连,外电路转移的电子数为0.08mol | |
| D. | 装置④中,离子交换膜应为阴离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ③④⑦ | C. | ②⑤⑦ | D. | ②④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com