
| A、原子半径减小 |
| B、电离能增大 |
| C、电负性增大 |
| D、均是周期性增大 |


科目:高中化学 来源: 题型:
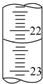 实验室中有一未知浓度的稀盐酸,某学生用0.10mol?L-1 NaOH标准溶液进行测定盐酸的浓度的实验.取20.00mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生用0.10mol?L-1 NaOH标准溶液进行测定盐酸的浓度的实验.取20.00mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.请完成下列填空:| 实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol?L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
| 1 | 20.00 | 0.10 | 24.18 |
| 2 | 20.00 | 0.10 | 23.06 |
| 3 | 20.00 | 0.10 | 22.96 |
查看答案和解析>>
科目:高中化学 来源: 题型:
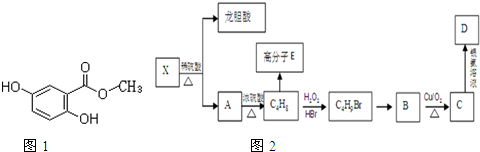
| H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
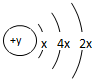 ,D在同周期元素中原子半径最小,据此填空:
,D在同周期元素中原子半径最小,据此填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a>b | B、a<b |
| C、a=b | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Na+、NO3-、MnO4- |
| B、Mg2+、Na+、Cl-、SO42- |
| C、K+、Na+、Br-、Cu2+ |
| D、Na+、Ba2+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
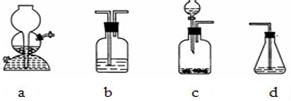 为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.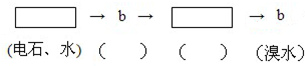
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com