
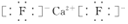 ;Y2与NaOH溶液反应的产物之一是OY2,该反应的离子方程式为2F2+2OH-=OF2↑+2F-+H2O.
;Y2与NaOH溶液反应的产物之一是OY2,该反应的离子方程式为2F2+2OH-=OF2↑+2F-+H2O. 分析 Ⅰ.若X的氧化物、氯化物都是实验室常用的干燥剂,则X为Ca,X的原子序数比Y大4,可知Y为S;
Ⅱ.若X是金属性最强的短周期元素,应为Na,则Y为N元素;
Ⅲ.若X的离子半径是第三周期离子半径最小的,应为Al,则Y为F元素,以此解答该题.
解答 解:Ⅰ.若X的氧化物、氯化物都是实验室常用的干燥剂,则X为Ca,X的原子序数比Y大4,可知Y为S,
(1)含有X元素的一种盐溶液和Y的一种气态氧化物均是工农业生产中常见的漂白剂,分别为Ca(ClO)2、SO2,二者发生氧化还原反应,反应的化学方程式为SO2+H2O+Ca(ClO)2=CaSO4↓+HClO+HCl,
故答案为:SO2+H2O+Ca(ClO)2=CaSO4↓+HClO+HCl;
(2)酸性土壤改变会施用X的一种气态氧化物,但不能与氮肥同时施用,原因是CaO遇水生成碱,铵态氮肥会与碱反应生成NH3,而降低肥效,
故答案为:CaO遇水生成碱,铵态氮肥会与碱反应生成NH3,而降低肥效;
Ⅱ.若X是金属性最强的短周期元素,应为Na,则Y为N元素,
(3)钠性质活泼,易与水、氧气反应,与氧气反应生成过氧化钠,过氧化钠和与二氧化碳反应,则钠着火应用沙土扑灭,故答案为:沙子;
(4)Y与氢元素能形成一种摩尔质量为43g/mol的共价化合物,已知该物质受到撞击即可放出大量的气体,则应为HN3,撞击时发生反应的化学方程式为2HN3$\frac{\underline{\;撞击\;}}{\;}$H2↑+3N2↑,
故答案为:2HN3$\frac{\underline{\;撞击\;}}{\;}$H2↑+3N2↑;
Ⅲ.若X的离子半径是第三周期离子半径最小的,应为Al,则Y为F元素,
(5)Y与钙元素形成的化合物为氟化钙,电子式为 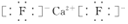 ;F2与NaOH溶液反应的产物之一是OF2,该反应的离子方程式为2F2+2OH-=OF2↑+2F-+H2O,
;F2与NaOH溶液反应的产物之一是OF2,该反应的离子方程式为2F2+2OH-=OF2↑+2F-+H2O,
故答案为: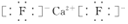 ;2F2+2OH-=OF2↑+2F-+H2O.
;2F2+2OH-=OF2↑+2F-+H2O.
点评 本题考查位置结构性质的相互关系应用,为高频考点和常见题型,侧重于学生的分析能力的考查,题目难度中等,正确推断元素的种类为解答该题的关键,注意原子结构和元素周期表的关系.


科目:高中化学 来源: 题型:选择题
| A. | 浓氨水可检验氯气管道漏气 | |
| B. | 碘是人体必需微量元素,所以要多吃富含高碘酸的食物 | |
| C. | 二氧化硫通入次氯酸钠溶液:SO2+ClO-+H2O=SO42-+Cl-+2H+ | |
| D. | 冷的NaOH溶液中通入Cl2:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2++2OH-═Mg(OH)2↓ Mg(NO3)2+Ba(OH)2═Mg(OH)2↓+Ba(NO3)2 | |
| B. | Fe+Cu2+═Fe2++Cu Fe+CuO═FeO+Cu | |
| C. | Ag++Cl-═AgCl↓ Ag2SO4+2HCl═2AgCl↓+H2SO4 | |
| D. | CO2+2OH-═CO32-+H2O CO2+2NH3•H2O═(NH4)2CO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 成分的质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 0.87 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.316 | 158 |
| 硝酸银 | 0.02 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是用来描述物质所含微粒数目多少的基本物理量 | |
| B. | 1 mol氯约含有 6.02×1023个微粒 | |
| C. | 水的摩尔质量是它的相对分子质量 | |
| D. | 1 cm3铁所含有的铁原子数是$\frac{ρ•{N}_{A}}{56}$( ρ是铁的密度,单位为 g/cm3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 控制高能耗企业上马 | |
| B. | 倡导“绿色化学”理念,逐步实现化工企业零排放 | |
| C. | 加大对污染企业的整治力度 | |
| D. | 无节制地开采煤、石油、天然气等矿物资源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
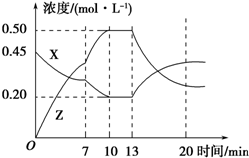
| A. | 用X表示0~10 min内该反应的平均速率为v(X)=0.045 mol•L-1•min-1 | |
| B. | 根据上图可求得化学方程式中a:b=1:3 | |
| C. | 推测在第7 min时曲线变化的原因可能是升温 | |
| D. | 推测在第13 min时曲线变化的原因可能是降温 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CH3COOH 溶液做导电性实验,灯泡很暗,能证明 CH3COOH 是弱电解质 | |
| B. | 将Ca(OH)2的饱和溶液加热,pH 和 Kw均增大 | |
| C. | 25℃时,1.0×10-3mol•L-1盐酸的pH=3.0,1.0×10-8 mol•L-1盐酸的pH=8.0 | |
| D. | 向pH相同的氨水和氢氧化钠溶液中分别加入适量NH4Cl(s)后,两溶液的pH均减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com