
| A. | ①②⑤ | B. | ④⑥ | C. | ③⑥ | D. | ③⑦ |
分析 ①没有指明p轨道电子和s轨道电子是否处于同一电子层;
②电负性是元素的原子在化合物中吸引电子能力的标度,电负性可以判断元素的金属性和非金属性;第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量;
③叁键有一个σ键、两个π键;
④含配位键的不一定是配合物,但配合物中一定含有配位键;
⑤含极性键的分子中,若结构对称,正负电荷重心重合,即为非极性分子;
⑥熔融状态下能导电的化合物中一定含有自由移动的离子,所以一定是离子化合物;
⑦原子晶体中半导体导电.
解答 解:①同一层即同一能级中的p轨道电子的能量一定比s轨道电子能量高,但外层s轨道电子能量则比内层p轨道电子能量高,故①错误;
②同周期从左到右,元素的非金属性依次增强,电负性越来越大,同一周期元素,元素的第一电离能随着原子序数增大而呈增大趋势,但第IIA族和第VA族元素第一电离能大于其相邻元素,故②错误;
③N2分子中存在N≡N,则有一个σ键、两个π键,故③正确;
④含配位键的不一定是配合物,如铵根离子不是络离子,氯化铵不是配合物而是离子化合物,故④错误;
⑤二氧化碳、甲烷等分子含有极性共价键,但结构对称为非极性分子,故⑤错误;
⑥熔融状态下能导电的化合物中一定含有自由移动的离子,含有离子键,所以一定是离子化合物,故⑥正确;
⑦原子晶体一般不导电,但是有的原子晶体也能够导电,如单质硅为半导体材料,能够导电,故⑦错误;
故选C.
点评 本题考查物质结构性质,涉及分子极性判断、离子化合物的判断、元素周期律、配合物等知识点,综合性较强,把握基本概念及元素周期律即可解答,注意第一电离能的变化规律及异常现象,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | Li在氧气中燃烧主要生成Li2O2 | |
| B. | 碱金属元素单质都能保存于煤油中 | |
| C. | 卤族元素单质的熔、沸点随原子序数的增大而升高而碱金属元素单质的熔、沸点随原子序数的增大而降低 | |
| D. | 第二周期非金属元素的气态氢化物溶于水后所得水溶液均呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | K+、AlO2-、Cl-、SO42- | B. | Fe2+、HCO3-、K2、SO42- | ||
| C. | Na+、Cl-、AlO2-、NO3- | D. | NH4+、NO3-、I-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
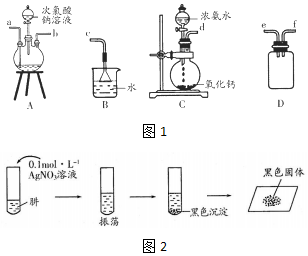
| 实验编号 | 操作 | 现象 | 实验结论 |
| 1 | 取少量黑色固体于试管,加入足量氨水,振荡 | 黑色固体不溶解 | 假设1成立 |
| 2 | 操作同实验1 | 黑色固体完全溶解 | 假设2成立 |
| 3 | ①取少量黑色固体于试管中,加入适量氨水,振荡,静置,取上层清液于洁净试管中,加入几滴乙醛,水浴加热②取少量黑色固体于试管中,加入足量稀硝酸,振荡 | ①试管内壁有银镜生成 ②固态完全溶解,并有气体产生 | 假设3成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
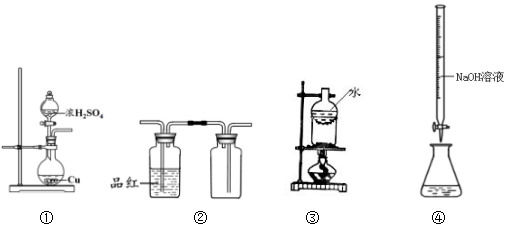
| A. | 用装置①制备SO2 | B. | 用装置②检验和收集SO2 | ||
| C. | 用装置③分离NaCl和I2 | D. | 用装置④测定溶液中c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
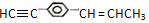 的说法正确的是( )
的说法正确的是( )| A. | 所有碳原子有可能都在同一平面上 | |
| B. | 最多只可能有9个碳原子在同一平面上 | |
| C. | 有7个碳原子可能在同一直线上 | |
| D. | 至少有6个碳原子在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
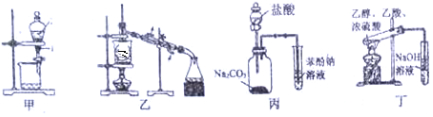
| A. | 装置甲:用CCl4萃取碘水中的碘 | |
| B. | 装置乙:用于从酒精水溶液中制取无水乙醇 | |
| C. | 装置丙:验证盐酸、碳酸、苯酚溶液的酸性 | |
| D. | 装置丁:用乙酸、乙醇制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,电池反应为:2Na+xS═Na2Sx,电池结构如图所示.下列说法不正确的是( )
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,电池反应为:2Na+xS═Na2Sx,电池结构如图所示.下列说法不正确的是( )| A. | 放电时,Na作负极,反应式为Na-e-=Na+ | |
| B. | 钠硫电池在常温下也能正常工作 | |
| C. | 放电时Na+向正极移动 | |
| D. | 当外电路通过0.25mol电子时消耗16g硫,则x=4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
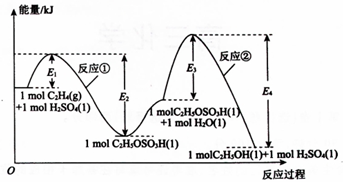 乙烯间接水合法合成乙醇分两步完成,反应过程中的能量变化如图所示,对于在密闭容器中进行的合成反应,下列说法不正确的是( )
乙烯间接水合法合成乙醇分两步完成,反应过程中的能量变化如图所示,对于在密闭容器中进行的合成反应,下列说法不正确的是( )| A. | H2SO4是乙烯间接水合法合成乙醇的催化剂 | |
| B. | 缩小容器容积,乙烯的转化率增大 | |
| C. | 反应①和反应②均为放热反应 | |
| D. | 反应②的反应热△H=-(E3-E4)kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com