
| A、C4H6 |
| B、C3H4 |
| C、C3H6 |
| D、C2H2 |


科目:高中化学 来源: 题型:
| 溶液 | a | b | c | d | e | f | a |
| 溶质 | CH3COONa | NaHCO3 | NaClO | NaCN | C6H5ONa | Na2CO3 | CH3COONa |
| pH | 8.8 | 9.0 | 10.3 | 11.1 | 11.3 | 11.6 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2(g)+O2(g)=2H2O(l)△H=-Q1 2H2(g)+O2(g)=2H2O(g)△H=-Q2 | ||||
| B、S(s)+O2(g)=SO2(g)△H=-Q1 S(g)+O2(g)=SO2(g)△H=-Q2 | ||||
C、C(s)+O2(g)=CO2(g)△H=-Q1 C(s)+
| ||||
D、H2(g)+Cl2(g)=2HCl(g)△H=-Q1
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、n=x(3-0.5m) |
| B、m=n+2x |
| C、m=n-6,m、n均与x无关 |
| D、n=m,m、n均与x无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:1 | B、1:2 |
| C、2:3 | D、1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe与Cl2反应生成FeCl3,Fe与S反应生成FeS,确定非金属性:Cl>S |
| B、用石墨作电极,电解Mg(NO3)2、Cu(NO3)2的混合溶液,确定铜、镁的金属活动性强弱 |
| C、进行H2O和H2S的热分解实验,确定硫和氧两种元素的非金属性强弱 |
| D、测定NaCl和NaF溶液的pH,确定F、Cl两元素非金属性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、W>X>Y>Z |
| B、W>Z>Y>X |
| C、X>Y>Z>W |
| D、Y>X>Z>W |
查看答案和解析>>
科目:高中化学 来源: 题型:
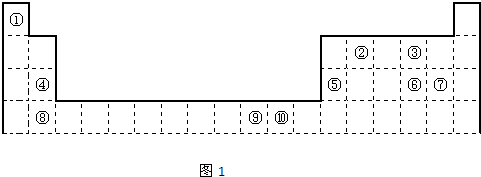
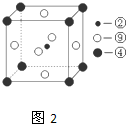 (图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为
(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢气与氮气能够缓慢地反应生成氨气,使用合适的催化剂可以提高化学反应速率 |
| B、等质量的锌粉和锌片与相同体积、相同浓度的盐酸反应,反应速率相等 |
| C、用铁片与硫酸制备氢气时,浓硫酸可以加快产生氢气的速率 |
| D、增大反应CO2(g)+H2(g)═CO(g)+H2O(g)的压强,反应速率不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com