
根据表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )
| 化学式 | 电离常数 |
| HClO | K=3×10﹣8 |
| H2 CO3 | K1=4.3×10﹣7 |
| K2=5.6×10﹣11 |
|
| A. | c(HCO3﹣)>c(ClO﹣)>c(OH﹣) |
|
| B. | c(ClO﹣)>c(HCO3﹣)>c(H+) |
|
| C. | c(HClO)+c(ClO﹣)=c(HCO3﹣)+c(H2CO3﹣) |
|
| D. | c(Na+)+c(H+)=c(HCO3﹣)+c(ClO﹣)+c(OH﹣) |
考点:
离子浓度大小的比较;盐类水解的原理.
专题:
压轴题;盐类的水解专题.
分析:
依据表提供的数据分析判断,弱电解质电离常数比较可知,等浓度的NaClO、NaHCO3混合溶液中碳酸氢根离子的水解程度小于次氯酸根离子的水解程度,依据溶液中电荷守恒,离子浓度大小比较依据,物料守恒等分析判断.
解答:
解:A、等浓度的NaClO、NaHCO3混合溶液中碳酸氢根离子的水解程度小于次氯酸根离子的水解程度,溶液中离子浓度大小为:c(HCO3﹣)>c(ClO﹣)>c(OH﹣),故A正确;
B、等浓度的NaClO、NaHCO3混合溶液中碳酸氢根离子的水解程度小于次氯酸根离子的水解程度,溶液中离子浓度大小为:c(HCO3﹣)>c(ClO﹣)>c(OH﹣),故B错误;
C、依据溶液中的物料守恒得到c(HClO)+c(ClO﹣)=c(HCO3﹣)+c(H2CO3)+c(CO32﹣),故C错误;
D、根据溶液中存在电荷守恒得到:c(Na+)+c(H+)=c(HCO3﹣)+c(ClO﹣)+c(OH﹣)+2c(CO32﹣),故D错误;
故选A.
点评:
本题考查了弱电解质的电离常数的分析应用,溶液中电荷守恒的分析判断,物料守恒的应用,比较碳酸氢根离子和次氯酸根离子的水解程度大小是解题的关键,题目难度中等.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
有A、B、C、D四块金属片,进行如下实验:
①A、B用导线相连后,同时浸入稀硫酸溶液中,A极为负极;
②C、D用导线相连后,同时浸入稀硫酸溶液中,电流由D→导线→C;
③A、C相连后,同时浸入稀硫酸溶液中,C极产生大量气泡;
④B、D相连后,同时浸入稀硫酸溶液中,D极发生氧化反应.
据此,判断四种金属的活动性顺序是( )
|
| A. | A>B>C>D | B. | A>C>D>B | C. | C>A>B>D | D. | B>D>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂。试回答下列问题:
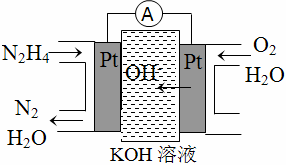
(1)肼燃料电池原理如图所示,左边电极上发生的电极反应式为____________________________________。
(2)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g) 2NO2(g) ΔH=-67.7kJ·mol-1
2NO2(g) ΔH=-67.7kJ·mol-1
N2H4(g)+O2(g) N2(g)+2H2O(g) ΔH=-534.0kJ·mol-1
N2(g)+2H2O(g) ΔH=-534.0kJ·mol-1
2NO2(g) N2O4(g) ΔH=-52.7kJ·mol-1
N2O4(g) ΔH=-52.7kJ·mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:________________________________________________________________。
(3)联氨的工业生产常用氨和次氯酸钠为原料获得,也可在高锰酸钾催化下,尿素[CO(NH2)2]和次氯酸钠—氢氧化钠溶液反应获得,尿素法反应的离子方程式为_____________________________________________________。
(4)如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L。
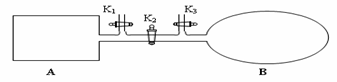
①B中可通过__________________________判断可逆反应2NO2 N2O4已经达到平衡。
N2O4已经达到平衡。
②若平衡后在A容器中再充入0.5mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数________(填 “变大”、“变小”或“不变”)
③若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)等于____________________。
④若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知当NH4Cl溶液的浓度小于0.1mol/L时,其pH>5.1.现用0.1mol/L的盐酸滴定10mL0.05mol/L的氨水,用甲基橙作指示剂达到终点时所用盐酸的量应是( )
|
| A. | 10mL | B. | 5mL | C. | 大于5mL | D. | 小于5mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.检查滴定管是否漏水
B.用蒸馏水洗干净滴定管
C.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
D.用待测定的溶液润洗酸式滴定管
E.用酸式滴定管取稀盐酸20.00mL,注入锥形瓶中,加入酚酞
F.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
G.另取锥形瓶,再重复操作一次
完成以下填空:
(1)操作F中应该选择图中 滴定管(填标号).
(2)滴定时边滴边摇动锥形瓶,眼睛应观察 .
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
滴定终点溶液颜色的变化是 .若指示剂改为甲基橙则颜色的变化是 .
(3)滴定结果如表所示:
| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL |
|
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 20 | 1.02 | 21.03 |
| 2 | 20 | 2.00 | 25.00 |
| 3 | 20 | 0.60 | 20.59 |
滴定中误差较大的是第 2 次实验,造成这种误差的可能原因是 .
A.碱式滴定管在装液前未用标准NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D.达到滴定终点时,仰视溶液凹液面最低点读数
E.滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
(4)该盐酸的浓度为 mol/L.
(5)如果准确移取20.00mL 0.1000mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度? (填“是”或“否”).
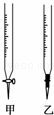
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机物的说法中,正确的是( )
|
| A. | 乙烯、苯、乙醇均能使紫色的酸性高锰酸钾溶液褪色 |
|
| B. | 乙烯和聚丙烯都能与氢气在一定条件下发生加成反应 |
|
| C. | 油脂在碱的作用下可发生水解,工业上利用该反应生产肥皂 |
|
| D. | 乙酸乙酯、油脂、果糖、蛋白质都可以发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
22011年9月,中国女科学家屠呦呦获得被誉为诺贝尔奖“风向标”的拉斯克奖,这是中国医学界迄今为止获得的世界级最高级大奖.她获奖理由是:“因为创制新型抗疟药﹣﹣青蒿素和双氢蒿素,挽救了全球特别是发展中国家的数百万人的生命.”已知结构如右图所示,则下列说法正确的是( )

|
| A. | 青蒿素与维生素C一样易溶于水 |
|
| B. | 青蒿素的晶体为分子晶体,其化学式为C16H20O5 |
|
| C. | 青蒿素不能与NaOH溶液反应 |
|
| D. | 青蒿素中含有过氧键,一定条件下有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有机化学方程式书写正确的是( )
|
| A. | CH4+Cl2 |
|
| B. |
|
|
| C. | H2C=CH2+Br2→CH3CHBr2 |
|
| D. | CH3CH2OH+CH3COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com