
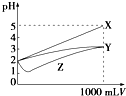
 pH=2的X、Y、Z三种酸的溶液各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的变化关系如图所示,下列说法错误的是( )
pH=2的X、Y、Z三种酸的溶液各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的变化关系如图所示,下列说法错误的是( )| A、X是强酸,Y和Z是弱酸 |
| B、稀释前的浓度大小为c(Z)>c(Y)>c(X) |
| C、稀释前电离程度大小为X>Y>Z |
| D、pH=2时,X、Y、Z都是稀溶液 |


科目:高中化学 来源: 题型:
| A、在上述条件下,44.8L氟化氢气体分解成22.4L氢气与22.4L氟气吸收270kJ热量 | ||||
| B、在上述条件下,1mol氢气与1mol氟气反应生成2mol液态氟化氢放出热量大于270kJ | ||||
| C、在上述条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量 | ||||
D、上述热化学方程式还可表示为:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)△H=b kJ/mol,在温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化如图.下列说法正确的是( )
工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)△H=b kJ/mol,在温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化如图.下列说法正确的是( )| A、T1>T2 |
| B、b>0 |
| C、K(T1)>K(T2) |
| D、a点时NO2的转化率为33.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③⑥ | B、①②③④ |
| C、①②⑥⑦ | D、①②③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 如图表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂 |
B、 如图表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A |
C、 如图表示纯碱溶液受热时氢氧根浓度随温度的变化 |
D、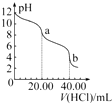 如图是用0.100 0 mol?L-1的盐酸滴定20.00 mL Na2CO3溶液的曲线,从a→b点反应得离子方程式为HCO3-+H+═CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com