
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
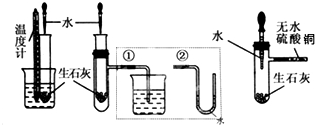
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
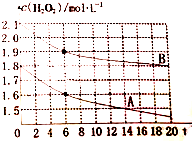 现有如下溶液:①1.0mL0.10mol•L-1双氧水 ②1.0mL0.20mol•L-1双氧水 ③3.0mL0.10mol•L-1KMnO4溶液 ④3.0mL0.010mol•L-1KMnO4溶液.所有实验均需加入1.0mL稀硫酸(足量),依据褪色时间长短判定反应速率快慢:
现有如下溶液:①1.0mL0.10mol•L-1双氧水 ②1.0mL0.20mol•L-1双氧水 ③3.0mL0.10mol•L-1KMnO4溶液 ④3.0mL0.010mol•L-1KMnO4溶液.所有实验均需加入1.0mL稀硫酸(足量),依据褪色时间长短判定反应速率快慢:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、NH4+、Cl-、SO42- | B. | Na+、Cl-、SO42-、HCO3- | ||
| C. | Na+、CH3COO-、NO3-、K+ | D. | K+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若向2mL 1mol/LNaOH溶液中先加入2滴1mol/L MgCl2溶液,再加入2滴1mol/L的FeCl3溶液,可以证明Mg(OH)2沉淀转化为Fe(OH)3沉淀 | |
| B. | 常温下,某溶液中由水电离出来的c(OH-)=1.0×10-12mol•L-1,则该溶液可能为盐酸,也可能为NaOH溶液 | |
| C. | 处理锅炉水垢中的CaSO4时,依次加入饱和NaCO3溶液和盐酸,水垢溶解,说明溶解度:S(CaCO3)<S(CaSO4) | |
| D. | 常温下的醋酸铵溶液呈中性,则溶液中c(H+)=c(OH-)=1.0×10-7mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 互为同系物的有机物其组成元素相同,且结构必须相似 | |
| B. | 正戊烷分子中所有碳原子均在一条直线上 | |
| C. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 | |
| D. | 互为同系物的有机物其相对分子质量数值一定相差14 n(n为正整数) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com