
| A、硫原子的2p轨道和氢原子的1s轨道 |
| B、硫原子的2p轨道和氢原子的2p轨道 |
| C、硫原子的3p轨道和氢原子的1s轨道 |
| D、硫原子的2p轨道和氢原子的3p轨道 |
科目:高中化学 来源: 题型:
 【选做题--物质结构与性质】
【选做题--物质结构与性质】查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 内 容 | 实 验 方 法 | 实 验 现 象 |
| 验证氧化性 | ||
| 验证不稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
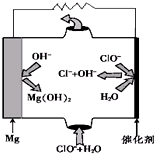 硫酸盐主要来自地层矿物质,多以硫酸钙、硫酸镁的形态存在.
硫酸盐主要来自地层矿物质,多以硫酸钙、硫酸镁的形态存在.| 温度(℃) | 527 | 758 | 927 |
| 平衡常数 | 784 | 1.0 | 0.04 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X元素的电子排布式为:1S22S22P63S23P63d104s24p64d65s2 |
| B、X元素位于第五周期 |
| C、X元素位于VIB族 |
| D、X元素原子最外层有2个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定含有CO32- |
| B、用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定含有Na+ |
| C、向某溶液中滴加BaCl2溶液产生白色沉淀,再滴加稀HNO3沉淀不溶解,则原溶液中一定含有SO42- |
| D、向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com