
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
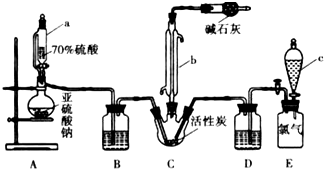 硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:
硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y |
| A | Al | NaOH溶液 |
| B | NO2 | H2O |
| C | Na2O2 | CO2 |
| D | Cu | 浓HNO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.25 | B. | 0.1 | C. | 0.5 | D. | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
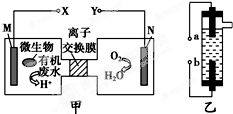
| A. | 装置甲可以在高温环境中工作 | |
| B. | 装置甲中N极发生的电极反应为O2+4H++4e-═2H2O | |
| C. | 装置乙中b极的电极反应式为2H++2e-═H2↑ | |
| D. | 装置乙的a极要与装置甲的Y极连接 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
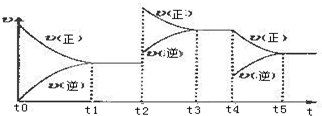
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com