
【题目】亚磷酸钠(Na2HPO3)溶液电渗析法制备H3PO3(亚磷酸)的原理如图所示,下列有关说法不正确的是( )
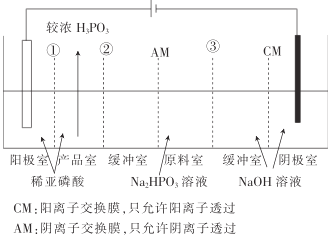
A.膜①、②、③均为CM
B.阴极的电极反应式为2H2O+2e-=2OH-+H2↑
C.阳极的电极反应式为2H2O-4e-=4H++O2↑
D.在原料室与产品室间设计缓冲室的主要目的是提高产品的纯度
【答案】A
【解析】
利用电解池制备H3PO3和NaOH,原料室中加入Na2HPO3,在电解池中阳离子向阴极移动,则Na+向右侧移动到达阴极室,在阴极,H+放电,电极方程式为2H2O+2e-=H2↑+2OH-,生成NaOH。HPO32-向阳极移动,到达产品室,在阳极,OH-放电,电极方程式为4H2O-4e-=O2↑+4H+,生成的H+向右侧移动,到达产品室,与HPO32-结合生成H3PO3,则①为CM,②为AM。
A.根据分析HPO32-向阳极移动,到达产品室。在阳极,OH-放电,电极方程式为4H2O-4e-=O2↑+4H+,生成的H+向右侧移动,到达产品室,与HPO32-结合生成H3PO3,则①为CM,②为AM,错误,A符合题意;
B.在阴极,H+放电,电极方程式为2H2O+2e-=H2↑+2OH-,正确,B不符合题意;
C.在阳极,OH-放电,电极方程式为4H2O-4e-=O2↑+4H+,正确,C不符合题意;
D.在产品室和原料室之间,设计缓冲室,可以减少杂质离子达到产品室,可以提高产品纯度,正确,D不符合题意。
答案选A。


科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜发明的“侯氏制碱法”联合合成氨工业生产纯碱和氮肥,工艺流程图如下。碳酸化塔中的反应:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。

下列说法不正确的是
A.以海水为原料,经分离、提纯和浓缩后得到饱和氯化钠溶液进入吸氨塔
B.碱母液储罐“吸氨”后的溶质是NH4Cl和NaHCO3
C.经“冷析”和“盐析”后的体系中存在平衡 NH4Cl(s) ![]() NH4+(aq) + Cl-(aq)
NH4+(aq) + Cl-(aq)
D.该工艺的碳原子利用率理论上为 100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,AgCl(s)![]() Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是

A.c点对应的Ksp等于a点对应的Ksp
B.加入AgNO3,可以使溶液由c点变到d点
C.d点没有AgCl沉淀生成
D.加入少量水,平衡右移,Cl-浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)=2HF(g) △H1=-270kJmol-1。下列说法不正确的是( )
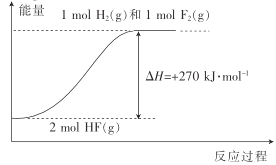
A.1molH2(g)与1molF2(g)的键能之和比2molHF(g)的键能高270kJ·mol-1
B.HF(g)分解为H2(g)与F2(g)的反应过程的能量变化可用如图来表示
C.若反应中有20gHF(g)生成,则放出135kJ热量
D.若H2(g)+Cl2(g)=2HCl(g) △H2=-QkJ·mol-1,则Q<270
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积可变的密闭容器中加入WO3和H2进行反应:WO3(s)+3H2(g)![]() W(s)+3H2O(g),下列说法不正确的是( )
W(s)+3H2O(g),下列说法不正确的是( )
A.将容器的体积缩小一半,其反应速率增大
B.保持体积不变,充入氩气,其反应速率不变
C.保持压强不变,充入氖气,H2O(g)的生成速率增大
D.保持压强不变,充入氖气,H2O(g)、H2(g)的生成速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)如图是自来水表的常见安装方式,发生腐蚀过程中,电流从___(填“接头流向水表”或“水表流向接头”)。

(2)某二次电池放电的电池反应为2Fe+O2+2H2O=2Fe(OH)2。反应结束时,电池的负极的质量___(“减小”“不变”或“增加”),该电池的正极反应式为___。
(3)有如图装置:
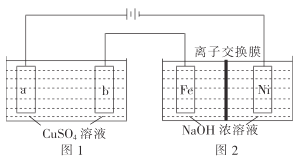
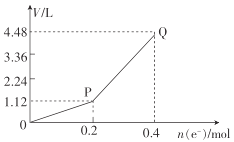
①图1中,用惰性电极电解过程中的实验数据如图,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中图1装置中产生气体的总体积(标准状况)。电解过程中转移n(e-)=0.4mol,b电极的实验现象为___;Q点时,a电极收集到的气体体积为___。
②图2中,装置通电后,溶液仍然保持澄清,铁电极附近呈紫红色(已知FeO42-在水溶液中呈紫红色),Fe电极上发生的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法正确的是
A.39g苯蒸气含碳碳双键的数目为1.5NA
B.将1molNH4NO3溶于适量稀氨水中,所得溶液呈中性,则溶液中NH4+的数目为NA
C.高温下,16.8gFe与足量水蒸气完全反应,转移的电子数为0.45NA
D.电解饱和食盐水消耗2molNaCl,加入含2mol HCl的盐酸可恢复到电解前的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是一种银白色的金属,常用于金属加工、电镀等。工业以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬及获得强氧化剂Na2Cr2O7。其工艺流程如图所示:

已知:高温氧化时发生反应Fe(CrO2)2+Na2CO3+O2→Na2CrO4+Fe2O3+CO2(未配平)
回答下列问题:
(1)将铬铁矿的主要成分Fe(CrO2)2写成氧化物的形式:__,高温氧化时可以提高反应速率的方法为___(写出一条即可)。
(2)Na2CrO4加入硫酸酸化的离子方程式为__;在实验室中,操作a所用到的玻璃仪器有__。
(3)Na2CrO4中铬元素化合价为__;生成1molNa2CrO4时共转移电子的物质的量为__mol。
(4)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol·L-1以下才能排放,可采用加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入硫酸处理多余的Ba2+的方法处理废水,加入可溶性钡盐后,废水中Ba2+的浓度应大于__mol·L-1,废水处理后达到国家标准才能排放。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产生活中有着广泛的应用。
(1)基态Ni原子价电子中成对电子数与未成对电子数之比为_______.。
(2)已知FeF3 具有较高的熔点(熔点高于1000℃),FeBr3 的式量大于FeF3,但其熔点只有200℃,原因是_____________________________________________________________________。
(3)Co3+的一种配离子[Co(N3)(NH3)5]2+,1mol该配离子中所含σ键的数目为____,与N3-互为等电子体的一种分子为:_______,N3-离子杂化类型为________。
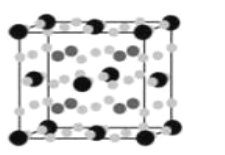
(4)金属Fe与Mg、H形成的化合物是目前人类已发现的体积储氢密度最高的储氢材料之一,其晶胞结构如图所示,其中黑球代表Fe,深灰色小球代表Mg,浅灰色小球代表H,其中浅灰色小球除在棱上、面上以外,在晶胞内部还有6个。试写出该化合物的化学式:__________________。

(5)NiO的晶体结构如图所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为_______________。一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图),已知O2-的半径为apm,每平方米面积上分散的该晶体的质量为__________g(用含a、NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com