
����Ŀ�����������֪ʶ���
![]() +R2-CHO ��
+R2-CHO ��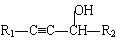 ��R������������ͬ����
��R������������ͬ����
![]() +H2
+H2![]()
![]()
1��4�D��������������������PBT���۶Ա������ᶡ����������Ҫԭ�ϣ�������ͨ����ͼ���ֲ�ͬ�ĺϳ�·���Ʊ�����д����Ӧ���ʵĽṹ��ʽ
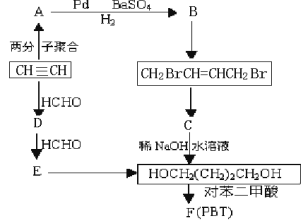
(1)��д��A��D�Ľṹ��ʽ��________________________��_____________________��
(2)д������CH2BrCH=CHCH2Br�Ļ�ѧ��Ӧ����ʽ��______д������F (PBT)�Ļ�ѧ��Ӧ����ʽ:___��
(3)���ڶԱ�������Ľṹ����ͬһֱ���ϵ�ԭ�������________����
(4)ijѧ���о���������Ȳ���Ƶ��Ҷ�����������Ƴ������ķ�Ӧ����ͼ��________________
��ʾ���ٺϳɹ��������Լ���ѡ �ڷ�Ӧ����ͼ��ʾ����ʾ�����£�
![]()
���𰸡�CH��CCH=CH2 CH��CCH2OH CH2=CHCH=CH2+Br2��CH2BrCH=CHCH2Br nHOCH2(CH2)2CH2OH+![]() ��
��![]() +2nH2O 4��
+2nH2O 4�� ![]()
��������
��Ȳ���ȩ�����ӳɷ�Ӧ����DΪHC��CCH2OH��D���ȩ��һ�������ӳɷ�Ӧ����EΪHOCH2C��CCH2OH��E�����������ӳɷ�Ӧ����HOCH2CH2CH2CH2OH��������Ȳ�ۺϵõ�AΪHC��CCH=CH2�������Ϣ����֪����HOCH2CH2CH2CH2OH����֪����A�����������ӳɷ�Ӧ����BΪCH2=CHCH=CH2��B���巢��1��4-�ӳɷ�Ӧ����BrCH2CH=CHCH2Br��BrCH2CH=CHCH2Br�����������ӳɷ�Ӧ����CΪBrCH2CH2CH2CH2Br��C����ˮ�ⷴӦ�õ�HOCH2CH2CH2CH2OH��1��4-��������Ա������ᷢ�����۷�Ӧ����PBTΪ![]() ������Ȳ���Ҷ�������������Ȳ�������ӳ�������ϩ����ϩ����ӳ�����1��2-�������飬1��2-���������ٷ�������ˮ��ɵ��Ҷ������ݴ˷�����
������Ȳ���Ҷ�������������Ȳ�������ӳ�������ϩ����ϩ����ӳ�����1��2-�������飬1��2-���������ٷ�������ˮ��ɵ��Ҷ������ݴ˷�����
(1)��������������֪��AΪHC��CCH=CH2��DΪHC��CCH2OH����Ϊ��HC��CCH=CH2��HC��CCH2OH��(2)CH2=CHCH=CH2���巢��1��4�ӳɷ�Ӧ����BrCH2CH=CHCH2Br����ѧ����ʽΪ��CH2=CHCH=CH2+Br2��CH2BrCH=CHCH2Br��1��4-��������Ա������ᷢ�����۷�Ӧ����PBT����Ӧ����ʽΪ��  ��
��
(3)���ڶԱ�������Ľṹ����ͬһֱ���ϵ�ԭ��Ϊ���ڱ�����λ�ϵ�����̼ԭ�Ӻ�������ԭ�ӣ��������4������Ϊ��4��
(4) ����Ȳ���Ҷ�������������Ȳ�������ӳ�������ϩ����ϩ����ӳ�����1,2-�������飬1,2-���������ٷ�������ˮ��ɵ��Ҷ�������Ӧ�ĺϳ�·������ͼΪ��![]() ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ŷš�̫���ܡ���ɫ��Դ�ȸ߿Ƽ�����2010�Ϻ�������
��1����������Χ������̬��ͣ�������к�β�������ⴥýͿ�Ϸֽ�Ϊ�����ʣ�����β���е��������������ɼ��Լ��γɵķǼ��Է��ӵ���____��
a��CO b��NO c��NO2 d��CO2
��2����һ���Ĺ����а�װ�˸����Ƚ��ܵ��մɽ�±�ƣ���±���������ͨ������NA��81Tl��49In��SC��I��Ԫ�صĵ��ʻ���й�˵����ȷ����_____��
a���ڢ�AԪ�����������һ������TlС��In
b��Ԫ��Scλ�����ڱ�s��
c���Ƶ��۵�ͣ�����Ϊ����������
d��I2����KI��Һ���ɲ���I3-���ɼ۲㻥�����ۿ���֪I3-��ֱ����
��3��������㷺�����˱�����յ���������յ�����Һ̬�������Ҷ��ͣ�HOCH2CH2OH�����ʣ��Ҷ����е�ߣ�������_____��
��4���Ϻ��������ģ����ʹ����21������ɫ��Դ��LED�뵼��������LED��Ƭ�����黯�أ�GaAs���Ȳ�����ɡ�����Gaԭ���ڻ�̬ʱ����������Ų�ʽΪ��_____��GaAs�ľ����ṹ��ͼ�������к���ԭ����Ϊ_____��

��5��������֮�������й��ݣ�����װ��7000����ɫ���壬��ɫ����Ϊ���ͷ�̼��Ϳ�Ͳģ�һ�ַ�̼Ϳ���֬��FEP�������ĵ���ΪCF3��CF=CF2���÷�����̼ԭ�ӵ��ӻ���ʽ�У�_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I���Ҷ����������ᣬΪ�˲ⶨ���ᾧ��(H2C2O4��xH2O)�е�xֵ��ͨ���������ϣ�����������ˮ��ˮ��Һ����������KMnO4��Һ���еζ���2MnO4-��5H2C2O4��6H��=2Mn2����10CO2����8H2O��ѧϰС���ͬѧ����˵ζ��ķ����ⶨxֵ��
�ٳ�ȡ1.260 g�����ᾧ�壬�����Ƴ�100.00 mLˮ��ҺΪ����Һ��
��ȡ25.00 mL����Һ������ƿ�У��ټ���������ϡH2SO4��
����Ũ��Ϊ0.1000 mol��L��1������KMnO4����Һ���еζ����ﵽ�յ�ʱ����10.00 mL��
(1)�ζ�ʱ��������KMnO4��Һװ��____________�ζ���(������ʽ��������ʽ��)��
(2)��ʵ��ζ��ﵽ�յ�ı�־��__________________________��
(3)ͨ���������ݣ����x��________��
���ۣ�
�����ζ��յ�ʱ���ӵζ��̶ܿȣ����ɴ˲�õ�xֵ��________(����ƫ������ƫС����������������ͬ)��
�����ζ�ʱ���õ�����KMnO4��Һ����ö�����Ũ�ȱ�С�����ɴ˲�õ�xֵ��________��
II��(1)25��ʱ��amolL-1�İ�ˮ��0.01molL-1�������������������Һ��c(NH4+)=c(Cl-)���ú�a�Ĵ���ʽ��ʾNH3H2O�ĵ���ƽ�ⳣ��Kb=______
(2)25��ʱ��H2SO3 ![]() HSO3��+ H+�ĵ��볣��Ka = 1��10-2molL��1������¶���pH=3��
HSO3��+ H+�ĵ��볣��Ka = 1��10-2molL��1������¶���pH=3��
c(HSO3��)= 0.1molL-1��NaHSO3 ��Һ��c(H2SO3)=______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ����
(1)��ҵ�ϳɰ���ҵ���õĴ�����____________,�����ӵĵ���ʽ��__________
(2)ͼ��һ�����¶Ⱥ�ѹǿ����N2��H2��Ӧ����1molNH3�����������仯ʾ��ͼ����д����ҵ�ϳɰ����Ȼ�ѧ��Ӧ����ʽ_______��������Q����ֵ�ú���ĸa��b�Ĵ���ʽ��ʾ��
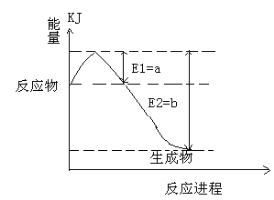
(3)�����йظ÷�Ӧ��˵����ȷ����_____������ţ�
A.����������������䣬�����������ܶȲ���ʱ��˵����Ӧ�Ѿ��ﵽƽ��״̬��
B.�ﵽƽ��ʱ�������¶ȣ���������е�Ԫ�ص��������������
C.�ﵽƽ��ʱ���������������������Ӧ���ʽ������淴Ӧ���ʡ�
D.�ﵽƽ���N2��ת���ʺ�H2��ת����һ����ȡ�
(4)�ڴ��������£�NH3����������NO����Ⱦ���������ֶԻ����������ʡ�д����Ӧ�Ļ�ѧ����ʽ��_____________________;�÷�Ӧ�����������뻹ԭ��������ʵ���֮����___________
(5)��NH3ͨ��������Һ�У�������Һ��pH=7, ��ʱ��Һ������Ũ�ȹ�ϵ��__________ ; ______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij��Һ��ֻ����OH-��H+��NH4+��Cl-�������ӣ�ijͬѧ�Ʋ�������Ũ�ȴ�С˳�������¼���
��c��Cl-����c��NH4+����c��H+����c��OH-��
��c��Cl-����c��NH4+����c��OH-����c��H+��
��c��NH4+����c��Cl-����c��OH-����c��H+��
��c��Cl-����c��H+����c��NH4+����c��OH-��
��1��������ϵһ������ȷ����_______________������ţ���
��2������Һ��ֻ��һ�����ʣ��������Ϊ__________������Һ������Ũ�ȵĴ�С��ϵΪ_______������ţ���
��3������ϵ����ȷ������Һ������Ϊ_________��
��4������������Ũ�ȹ�ϵ��c��NH4+��=c��Cl-���������Һ��_________������������������������������������
��5��25����pH=a������VamL��pH=14-a�İ�ˮVbmL��ϣ�����Һ�����ԣ���Va__________Vb���������=����ȷ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�����
(1)NH4Cl��Һ�����ԣ������ӷ���ʽ��ʾ��ԭ��___________________________________��
(2)25��ʱ1g������ȫȼ�����ɶ�����̼�����Һ̬ˮ���ų�56ǧ����������д���÷�Ӧ���Ȼ�ѧ����ʽ��_____________________________ ��
(3)���ڿ����з���������ʴʱ��������Ӧ����ʽ��_________________________________
(4)����ͭ��Һͨ��ʱ�����Ļ�ѧ��Ӧ����ʽ��_______________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������ۺϴ�����NH4+ ��ˮ��ҵ��������Ҫ��N2��CO2��SO2��NO��CO�������������ɷ֣���������������̣�
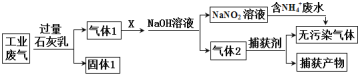
����˵������ȷ����
A.X�����ǹ����Ŀ���
B.����1����Ҫ����Ca(OH)2��CaCO3��CaSO3
C.������������������Ҫ��CO
D.������NH4+ ��ˮ,ÿ����1mol����Ⱦ����ת��3NA����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���۲�����װ�ã��ش��������⡣

(1) ��װ����ͨ���Ҵ��ĵ缫��ӦʽΪ_______________________________________��
(2) ����ͼװ�õ��200 mL 1mol/L CuSO4��Һ��ʯī�缫�ϵĵ缫��Ӧʽ��________����Ag�缫�����۲쵽��������_____________________________��
(3) ���һ��ʱ�䣬���׳�������112 mLO2(�����)����ʱ��װ������Һ��pHΪ_______(���Ե��ǰ������仯)����Ҫ������Һ��ȫ�ָ������ǰ��Ũ�Ⱥ�pH����Ҫ�����������_____________�������ʵ���Ϊ___________��
(4) ��װ�����ܷ�Ӧ�����ӷ���ʽΪ____________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ũ���������������Һ�У���������ɫ���壬����Һ���Ϻ�ɫ��ȥ������һ������ԭ��Ӧ����ϵ������KCl��Cl2��ŨH2SO4��H2O��KMnO4��MnSO4��K2SO4�������ʡ����������գ�
(1)д��һ�����������������ʵ�������ԭ��Ӧ����ʽ����ƽ���������ת�Ʒ������Ŀ��___________________________��
(2)������Ӧ�У���������_____________��ÿת��1 mol���ӣ�����Cl2_____ L����״������
(3)�ڷ�Ӧ�����Һ�м���NaBiO3(��������ˮ)����Һ�ֱ�Ϊ�Ϻ�ɫ��BiO3-��Ӧ���Ϊ��ɫ��Bi3+��д����ʵ�����漰��Ӧ�����ӷ�Ӧ����ʽ��_________________��
(4)��������ʵ�飬д��������Ӧ�������������������������ǿ��˳��__________��
(5)����������ԭ��Ӧ��ϵ�У����ڵ�������Ԫ�صļ����Ӱ뾶�ɴ�С��˳��Ϊ________
(6)��ԭ�ӵ��������ӵĹ��ʽΪ___________����ԭ�Ӻ�����_______��ͬ�˶�״̬�ĵ��ӡ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com