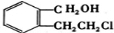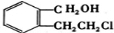(2013?德州一模)海水是应用前景广阔的化工原料资源,从海水中可提取各种化工原料.如图1是工业 上对海水的几项综合利用的示意图(已知气体X为电解饱和食盐水所得;母液苦卤中主要 含有Ca
2+、Mg
2+,Cl
-,SO
42?、Br
-等离子)请回答:
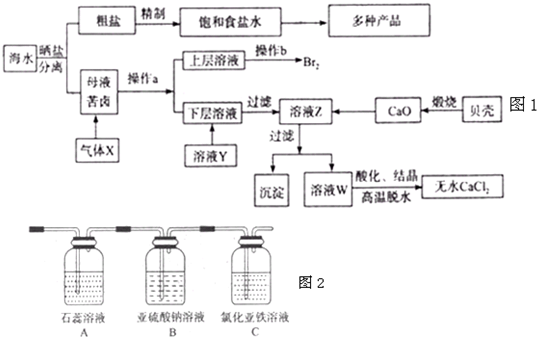
(1)在粗盐中含有Ca
2+、Mg
2+、SO
42-等杂质,梢制时所用的试剂为:A.盐酸B.氯化钡溶 液C.氢氧化钠溶液D.碳酸钠溶液,则加入试剂的顺序是(填编号)
BDCA 或 CBDA 或BCDA等
BDCA 或 CBDA 或BCDA等
.
(2)气体X的化学式为
Cl2
Cl2
,操作a所用的主要仪器是
分液漏斗
分液漏斗
.
(3)加入溶液Y的目的是
除去溶液中的SO42-
除去溶液中的SO42-
,用CaO调节溶液Z的pH,可以除去Mg
2+得到溶液W.由表中数据可知,理论上可选择pH最大范围是
11.0≤pH<12.2
11.0≤pH<12.2
.酸化溶液W时,使用的试剂为
盐酸
盐酸
.
|
开始沉淀时的pH |
沉淀完全时的pH |
| Mg2+ |
9.6 |
11.0 |
| Ca2+ |
12.2 |
c(OH-)=1.8mol?L-1 |
(4)将气体X依次通过如图2所示装置以验证气体X的性质:
①通入气体X后,A中出现的现象是
溶液先变红,后褪色;
溶液先变红,后褪色;
.
②C装置中发生反应的离子方程式为
2Fe2++Cl2═2Fe3++2Cl-
2Fe2++Cl2═2Fe3++2Cl-
.
③请你帮该小组同学设计一个实验,证明洗气瓶B中的Na
2SO
3已被氧化(简述实验步骤)
取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化.
取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化.
.




 名校课堂系列答案
名校课堂系列答案 (2013?德州一模)【化学一物质结构与性质】
(2013?德州一模)【化学一物质结构与性质】