
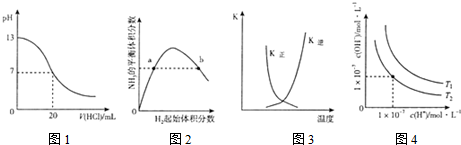
| A. | 图1表示25℃时,用0.lmol L-1盐酸滴定20mL 0.1mol•L-1NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图2表示一定条件下的合成氨反应中.NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率大于b点 | |
| C. | 图3表示恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 | |
| D. | 图4表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1 |
分析 A.0.1mol•L-1NaOH溶液,pH=13,用盐酸滴定时,pH减小,滴定终点时pH发生突变;
B.合成氨反应中,氢气越多,促进氮气的转化,氮气的转化率增大;
C.△H<0为放热反应,交叉点正逆反应速率相等,为平衡点,之后升高温度平衡逆向移动;
D.水的电离为吸热反应,图中T1时Kw大.
解答 解:A.0.1mol•L-1NaOH溶液,pH=13,用盐酸滴定时,pH减小,滴定终点时pH发生突变,图中没有pH的突变,故A错误;
B.合成氨反应中,氢气越多,促进氮气的转化,氮气的转化率增大,则a点N2的转化率小于b点,故B错误;
C.△H<0为放热反应,交叉点正逆反应速率相等,为平衡点,之后升高温度平衡逆向移动,K正减小、K逆增大,图象合理,故C正确;
D.水的电离为吸热反应,图中T1时Kw大,则图中温度T2<T1,故D错误;
故选C.
点评 本题考查中和滴定平衡移动的图象综合,为高频考点,把握滴定时pH的变化、平衡移动、水的电离为解答的关键,侧重分析与应用能力的考查,注意图象的分析与平衡移动原理的应用,题目难度不大.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:选择题
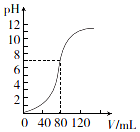 用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )
用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )| A. | 0.5 mol•L-1、160 mL | B. | 1.0 mol•L-1、160 mL | ||
| C. | 0.5 mol•L-1、80 ml | D. | 1.0 mol•L-1、80 ml |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
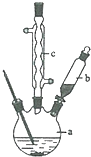 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: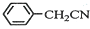 +H2O+H2SO4$\stackrel{100~130℃}{→}$
+H2O+H2SO4$\stackrel{100~130℃}{→}$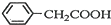 +NH4HSO4
+NH4HSO4 +Cu(OH)2→(
+Cu(OH)2→(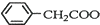 )2Cu+H2O
)2Cu+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)=xCO2(g)+$\frac{y}{2}$H2O(l)△H=($\frac{10Q}{9}$-1366.8)kJ•mol-1 | |
| B. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)=xCO2(g)+$\frac{y}{2}$H2O(l)△H=(-$\frac{10Q}{9}$+1366.8)kJ•mol-1 | |
| C. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)=xCO2(g)+$\frac{y}{2}$H2O(l)△H=($\frac{10Q}{9}$-151.9)kJ•mol-1 | |
| D. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)=xCO2(g)+$\frac{y}{2}$H2O(l)△H=(-$\frac{10Q}{9}$+151.9)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 反应mA(s)+nB(g)?pC(g)△H=-QkJ/mol在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )
反应mA(s)+nB(g)?pC(g)△H=-QkJ/mol在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )| A. | 只有① | B. | 只有②④ | C. | 只有①②④ | D. | 只有①和③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 946 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com