
| A. | 把SO2通入溴水中,溴水立即褪色,这是由于SO2具有漂白作用 | |
| B. | 氢硫酸是弱酸,不能与强酸盐反应生成强酸 | |
| C. | 稀硫酸不与铜反应,但把Cu片放在浓H2SO4中立即发生激烈反应 | |
| D. | 硫化亚铁不能存在于盐酸中,而硫化铜能存在于盐酸中 |
分析 A、二氧化硫具有还原性,溴单质具有氧化性,二者发生氧化还原反应;
B、氢硫酸和硫酸铜溶液反应生成硫化铜沉淀和硫酸;
C、铜和浓硫酸需要加热发生反应;
D、硫化亚铁不能存在于盐酸中,两者反应生成氯化亚铁和硫化氢;CuS既不溶于水,也不溶于稀盐酸.
解答 解:A、二氧化硫具有还原性,溴单质具有氧化性,二者发生氧化还原反应,SO2+Br2+2H2O=H2SO4+2HBr,反应中二氧化硫表现了还原性,故A错误;
B、氢硫酸和硫酸铜溶液反应生成硫化铜沉淀和硫酸,H2S+CuSO4=CuS↓+H2SO4,可以与强酸盐反应生成强酸,故B错误;
C、稀硫酸不与铜反应,铜和浓硫酸需要加热发生反应,故C错误;
D、硫化亚铁不能存在于盐酸中,两者反应生成氯化亚铁和硫化氢;CuS既不溶于水,也不溶于稀盐酸.故D正确;
故选D.
点评 本题考查了物质性质的分析判断,主要是硫起混合物性质的分析应用,特征反应和氧化还原反应是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、K+、SO42-、HCO3- | B. | Mg2+、Na+、SO42-、Cl- | ||
| C. | Na+、K+、SO42-、NO3- | D. | Ba2+、Na+、MnO4-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
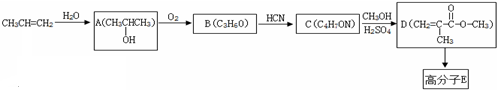
 .
.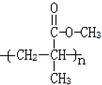 .
.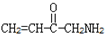 B.CH3CH2-N=CHCH2OH C.
B.CH3CH2-N=CHCH2OH C.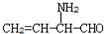 D.
D.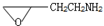
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=2 | |
| B. | 参加反应的Fe2+全部作还原剂 | |
| C. | 每生成1molFe3O4,反应转移电子的总物质的量为4mol电子 | |
| D. | 1molFe2+被氧化时,被Fe2+还原的O2的物质的量为$\frac{1}{3}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{2}$(10-9+10-11) mol•L-1 | B. | 2×10-11mol•L-1 | ||
| C. | (1×10-14-5×10-4) mol•L-1 | D. | (10-9+10-11) mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取、蒸发、分液 | B. | 分液、蒸馏、萃取 | C. | 分液、萃取、蒸馏 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
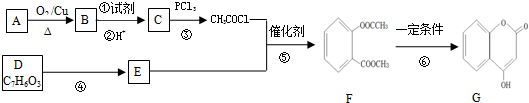
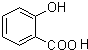 、
、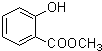 .
.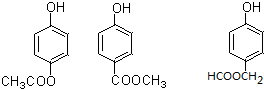 (写出一种即可).
(写出一种即可).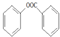 )是一种重要的有机合成中间体,参照化合物G的上述合成路线,设计一条以苯酚和甲苯为起始原料制备苯甲酸苯酚酯的合成路线
)是一种重要的有机合成中间体,参照化合物G的上述合成路线,设计一条以苯酚和甲苯为起始原料制备苯甲酸苯酚酯的合成路线 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com