
CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
 |
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式 。
 (2)NaClO3的作用是 。
(2)NaClO3的作用是 。
(3)加Na2CO3调pH至5.2所得沉淀为
。
(4)萃取剂对金属离子的萃取率与pH的关系如图。
萃取剂的作用是 ;
其使用的较适宜pH范围是 。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质
量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是
。(答一条即可)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O3(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A.△H1>0,△H3<0
B.△H2>0,△H4>0
C.△H1=△H2+△H3
D.△H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁均为中学化学常见的物质,它们之间的转化关系如图(反应条件及其它产物已略去).下列说法不正确的是( )

|
| A. | 若甲是AlCl3溶液,则丁可能是NaOH溶液 |
|
| B. | 若甲是Fe,则丁可能是Cl2 |
|
| C. | 若丁是CO2,则甲可能为Mg |
|
| D. | 若丁是O2,则乙、丙的相对分子质量可能相差16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1mol·L-1 NaHCO3溶液:K+、AlO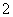 、Cl-、NO
、Cl-、NO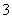
B.使甲基橙变红色的溶液:NH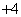 、Cu2+、ClO-、Na+
、Cu2+、ClO-、Na+
C.c(H+)=1×10-13 mol∙L-1的溶液中:Mg2+、Cu2+、SO42-、NO3-
D.遇苯酚变紫色的溶液:Na+、Mg2+、SO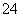 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.已知Ksp[Fe(OH)3]=4.0×10—38,则常温下Fe3++3H2O Fe(OH)3+3H+的平衡常数K=2.5×10—5
Fe(OH)3+3H+的平衡常数K=2.5×10—5
B.准确称取0.4000 g NaOH固体可配成100 mL 0.1000 mol·L—1的NaOH标准溶液
C.电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等
D.催化剂通过降低化学反应的焓变加快化学反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
2K3[Fe(C2O4)3]═3K2CO3+Fe+FeO+4CO↑+5CO2↑元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值。
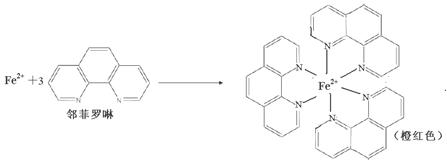
(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰。相关的反应如下:
4FeCl3+2NH2OH•HCl= 4FeCl2+N2O↑+6HCl+H2O
①Fe3+在基态时,核外电子排布式 ls22s22p63s23p63d6或[Ar]3d6 ;
②羟胺中(NH2OH)采用sp3杂化的原子有N、O ,三种元素电负性由大到小的顺
序为 ;
③Fe2+与邻啡罗啉(用A表示)形成的配合物[FeA3] 2+中,Fe2+的配位数为 6 ;
④N2O分子的空间构型为 (用文字描述)。
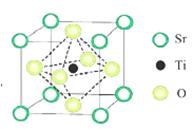 (2)分子氢的规模化制备是氢能应用的基础。在光化学电池中,以紫外线照钛酸锶电极时,可
(2)分子氢的规模化制备是氢能应用的基础。在光化学电池中,以紫外线照钛酸锶电极时,可
分解水制取H2同时获得O2。已知钛酸锶晶胞结构如
图所示,则钛酸锶的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某探究小组利用丙酮的溴代反应(CH3COCH3+B r2
r2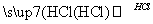 CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系.反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定.在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系.反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定.在一定温度下,获得如下实验数据:
| 实验 | 初始浓度c/mol/L | 溴颜色消失所需时间t/s | ||
| 序号 | CH3COCH3 | HCl | Br2 | |
| ① ② ③ ④ | 0.80 1.60
0.80 | 0.20 0.20 0.40 0.20 | 0.0010 0.0010 0.0010 0.0020 | 290 145
580 |
分析实验数据所得出的结论不正确的是 ( )
A.增大c(CH3COCH3),v(Br2)增大
B.实验②和③的v(Br2)相等
C.增大c(HCl),v(Br2)增大
D.增大c(Br2),v(Br2)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸、硝酸与盐酸是工业上常用的三大强酸。工业上制备硫酸常用接触法,工业上制硝酸是用氨的催化氧化法。下列关于工业上制硫酸与硝酸的说法中不正确的是( )
A.在沸腾炉中进行的反应为:4FeS2+11O2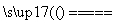 2Fe2O3+8SO2
2Fe2O3+8SO2
B.氨被氧气催化氧化:4NH3+5O2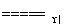 4NO+6H2O
4NO+6H2O
C.硫酸工业、硝酸工业都需要对工业尾气进行处理
D.接触法制硫酸的原料为:二氧化硫、空气、水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com