
| A. | X单质不易与水反应 | B. | XO2可被碳或氢气还原为X | ||
| C. | XH4的稳定性比SiH4的高 | D. | XCl4的沸点比SiCl4的高 |
分析 根据硅元素对应的单质和化合物的性质进行判断,Si位于周期表第三周期,原子最外层有4个电子,性质较稳定,结合元素周期律的递变规律分析.
解答 解:A.X和Si的性质相似,和水不反应,故A正确;
B.X位于周期表第四周期,非金属性比Si弱,XO2可被碳或氢还原为X,故B正确;
C.X位于周期表第四周期,非金属性比Si弱,则XH4的稳定性比SiH4的低,故C错误;
D.XCl4的沸点比SiCl4的结构相似,形成分子晶体,相对分子质量越大,分子间作用力越强,沸点越高,XCl4相对分子质量大,所以XCl4的沸点比SiCl4的高,故D正确.
故选:C.
点评 本题考查元素周期律的递变规律,题目难度不大,本题注意X和Si在周期表中的位置的判断.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | X的能量一定低于M的,Y的能量一定低于N的 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量 | |
| D. | 增加X的物质的量,该反应的化学反应速率一定加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ql+Q2<Q3 | B. | Ql+Q2>2Q3 | C. | 2Ql+Q2<4Q3 | D. | 2Ql+Q2>4Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
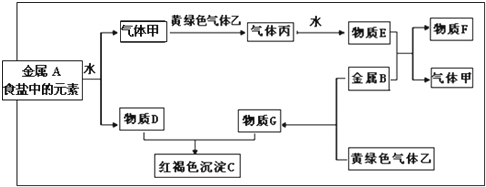
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石燃料在燃烧过程中会产生污染环境的CO、SO2等有害气体 | |
| B. | 直接燃烧煤不如将煤进行深加工后再燃烧的效果好 | |
| C. | 太阳能、氢能、风能、核能、天然气等都属于新能源 | |
| D. | 水煤气是一种二次能源,比煤直接燃烧污染小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
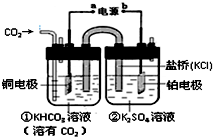
| A. | 该装置为原电池,其中a为正极 | |
| B. | 铜电极的电极反应式为:CO2+8H++8e-$?_{加热}^{催化剂}$CH4+2H2O | |
| C. | 反应开始后,电子从a极流出至铜电极,经电解质溶液到铂电极最后流回至b极 | |
| D. | 一段时间后,②池中溶液的pH一定下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷、甲苯、乙醇、乙酸都可以发生取代反应 | |
| B. | 能发生银镜反应的有机物都是醛 | |
| C. | 乙酸乙酯在无机酸或碱存在时都能发生水解反应 | |
| D. | 可用浓溴水来区分乙醇和苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
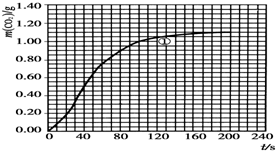 某探究小组用HNO3与大理石反应过程中质量减小的方法研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3用量为25.0mL,大理石用量为10.00g.
某探究小组用HNO3与大理石反应过程中质量减小的方法研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3用量为25.0mL,大理石用量为10.00g.| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格 (粗、细)对该反应速率 的影响. |
| ② | ||||
| ③ | ||||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | 只有③ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com